Desonide
Desonide (INN) là một loại thuốc chống viêm corticosteroid tại chỗ có hiệu lực thấp đã có từ những năm 1970. Nó chủ yếu được sử dụng để điều trị viêm da dị ứng (eczema), viêm da tiết bã, viêm da tiếp xúc và bệnh vẩy nến ở cả người lớn và trẻ em. Nó có một hồ sơ an toàn khá tốt [1] và có sẵn dưới dạng kem, thuốc mỡ, kem dưỡng da và dưới dạng bọt dưới tên thương mại Verdeso Bọt. Tên thương mại khác cho kem, nước thơm và thuốc mỡ bao gồm Tridesilon, DesOwen, Desonate. Nó là một corticosteroid nhóm VI theo phân loại của Hoa Kỳ, nhóm mạnh thứ hai.
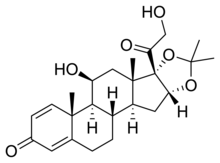 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Desowen |
| Đồng nghĩa | Prednacinolone; Hydroxyprednisolone acetonide; Desfluorotriamcinolone acetonide; (11β,16α)-11,21-Dihydroxy-16,17-[(1-methylethylidene)bis(oxy)]-pregna-1,4-diene-3,20-dione |
| AHFS/Drugs.com | Chuyên khảo |
| MedlinePlus | a605025 |
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | topical |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| ECHA InfoCard | 100.010.320 |
| Dữ liệu hóa lý | |
| Công thức hóa học | C24H32O6 |
| Khối lượng phân tử | 416.507 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Sử dụng trong y tế sửa
Desonide là một phương pháp điều trị tại chỗ theo toa cho đỏ, sưng, ngứa và khó chịu của các tình trạng da khác nhau. Bất kể đường sử dụng, desonide được áp dụng 2 đến 3 lần một ngày, vào cùng một thời điểm mỗi ngày. Tình trạng da thường cải thiện trong hai tuần đầu điều trị. Bệnh nhân được hướng dẫn sử dụng desonide trong khoảng thời gian tối thiểu cần thiết cho các điều kiện để cải thiện.[2]
Tác dụng phụ sửa
Độ an toàn của desonide chưa được xác định sau 4 tuần sử dụng.[2] Bệnh nhân bị dị ứng với corticosteroid (như hydrocortison hoặc prednison) nên thận trọng khi dùng desonide.[3] Dược sĩ và bác sĩ kê đơn nên lưu ý rằng thuốc này có thể chứa các thành phần không hoạt động hơn có thể gây ra phản ứng dị ứng.
Desonide không nên được sử dụng nếu có nhiễm trùng hoặc vết thương hở trong khu vực điều trị.
Hấp thu toàn thân corticosteroid tại chỗ có thể tạo ra tác dụng phụ. Dấu hiệu của hội chứng Cushing, tăng đường huyết và đường niệu đã được quan sát thấy ở một số bệnh nhân đang điều trị. Sau khi ngừng điều trị, có thể ức chế trục hạ đồi-tuyến yên-thượng thận (HPA) với khả năng bị thiếu glucocorticosteroid. Xét nghiệm trong phòng thí nghiệm cosyntropin (ACTH1-24) có thể đánh giá bệnh nhân về ức chế trục HPA.[2] Chức năng HPA có thể được đảo ngược sau khi ngừng điều trị hoặc thay thế bằng một loại corticosteroid khác ít mạnh hơn. Nếu thiếu glucocorticosteroid xảy ra, có thể cần dùng corticosteroid toàn thân.
Tác dụng phụ của desonide cần tiếp xúc ngay với bác sĩ kê đơn:
- Phồng rộp, nóng rát, đóng vảy, khô hoặc bong tróc da
- nóng rát, ngứa, đỏ, nổi mẩn da, sưng hoặc đau tại trang web ứng dụng
- đỏ bừng hoặc đỏ da
- kích thích
- ngứa, đóng vảy, đỏ nghiêm trọng, đau nhức hoặc sưng da
- bong tróc da
- nổi lên, màu đỏ sẫm, giống như mụn cóc trên da, đặc biệt là khi sử dụng trên mặt
- châm chích và đốt
- làn da ấm áp khác thường
Các tác dụng phụ có thể biến mất khi cơ thể điều chỉnh thuốc:
- Đau nhức cơ thể
- ớn lạnh
- ho
- khó thở
- tắc nghẽn tai
- sốt
- đau đầu
- mất giọng
- nghẹt mũi
- sổ mũi
- hắt xì
- viêm họng
- mệt mỏi bất thường hoặc yếu
Mang thai sửa
FDA đã dán nhãn desonide là loại thai kỳ C. Desonide chỉ nên được sử dụng trong khi mang thai khi thực sự cần thiết.
Cho con bú sửa
Hiện tại vẫn chưa biết liệu ứng dụng tại chỗ của Desonide có thể truyền vào sữa mẹ hay không. Các loại thuốc tương tự được dùng bằng đường uống đã được nhìn thấy để truyền vào sữa mẹ. Bác sĩ kê đơn nên được tư vấn trước khi cho con bú.
Cơ chế hoạt động sửa
Desonide là một corticosteroid không tổng hợp; corticosteroid tại chỗ có đặc tính chống viêm, chống ngứa và co mạch. Cơ chế của các tính chất này, tuy nhiên, không rõ ràng cho con đường quản trị da.[4] Sau khi hấp thụ qua da, corticosteroid theo con đường dược động học tương tự như corticosteroid tiêm tĩnh mạch. Cơ chế của corticosteroid được cho là tạo ra protein ức chế phospholipase A2 (lipocortin). Lipocortin kiểm soát sinh tổng hợp các chất trung gian gây viêm, như tuyến tiền liệt và leukotrien. Lipocortin có thể ức chế tiền chất phổ biến của các chất trung gian gây viêm, axit arachidonic.
Tương tác sửa
Các loại thuốc phổ biến gây tương tác thuốc âm tính nhỏ bao gồm: Insulin và Metformin. Các loại thuốc thông thường được kiểm tra kết hợp, nhưng không được biết là tạo ra tương tác thuốc âm tính, bao gồm: Aspirin, Cymbalta (duloxetine), Dầu cá, Acetaminophen, Vitamin B12, Vitamin C, Vitamin D3 và Zyrtec.[5]
Lịch sử sửa
Desonide lần đầu tiên được giới thiệu tại Hoa Kỳ dưới tên thương mại Tridesilon bởi Phòng thí nghiệm mái vòm vào năm 1970.[6] Kể từ khi phát hiện ra ở Hoa Kỳ, một số quốc gia khác đã giới thiệu các tên thương hiệu khác nhau của desonide, bao gồm Ý, Tây Ban Nha, Vương quốc Anh và Đức. FDA đã phê duyệt lần đầu tiên Verdeso Bọt® của Tập đoàn Connetics vào ngày 16 tháng 9 năm 2006.[7] Chỉ ngay sau đó, FDA đã phê duyệt phương tiện giao hàng hydrogel Desonate® của SkinMedica Inc. vào ngày 20 tháng 10 năm 2006.[8]
Gel Desonate® hiện được sản xuất bởi Công ty Dược phẩm Bayer HealthCare Inc. tại Whippany, NJ. Các loại kem, thuốc mỡ và kem bôi DesOwen® hiện đang được sản xuất bởi DPT Lab Laboratory, Ltd. tại San Antonio Texas và được bán bởi Phòng thí nghiệm Galderma. Các nhà cung cấp khác cho desonide chung bao gồm Rebel Dist Investors Corp và Perrigo New York Inc.
Nghiên cứu và thử nghiệm lâm sàng sửa
Desonate đã được FDA chấp thuận sau hai thử nghiệm lâm sàng lớn vào năm 2006. Mỗi nghiên cứu ngẫu nhiên, mù đôi, kiểm soát giả dược ghi nhận 582 bệnh nhân nhi (trong độ tuổi từ 3 tháng đến 18 tuổi).[9] Bệnh nhân được dùng tại chỗ thuốc hoặc giả dược hai lần một ngày trong bốn tuần. Sử dụng Điểm nghiêm trọng toàn cầu của Điều tra viên (IGSS), việc điều trị được coi là thành công nếu ở Tuần 4 có ít nhất hai (2) điểm giảm so với IGSS ban đầu của bệnh nhân. Trong thử nghiệm lâm sàng 1, 44% bệnh nhân đã điều trị thành công Desonate so với 14% được điều trị bằng giả dược. Trong thử nghiệm lâm sàng 2, 28% bệnh nhân đã điều trị thành công Desonate so với 6% được điều trị bằng giả dược.
FDA đã phê chuẩn Tridesilon cho các phương pháp điều trị sau: Viêm da tiếp xúc, Viêm da cơ địa, Viêm da, Viêm da, Bệnh viêm da do nấm, Bệnh viêm da do nấm, Bệnh viêm da do nấm, Bệnh viêm da do nấm, Bệnh viêm da do nấm, Bệnh viêm da do nấm, Bệnh viêm da do nấm, Bệnh viêm da do nấm.[10]
Gần đây, vào cuối năm 2014, các thử nghiệm lâm sàng giai đoạn 3 đã được hoàn thành để đánh giá các phương pháp điều trị sử dụng kem Desonide so với kem dưỡng ẩm amino acid.[11] Bệnh nhân bị bệnh chàm hoặc viêm da dị ứng có thể được ghi danh vào nghiên cứu này, cả nam và nữ, trên 18 tuổi. Nghiên cứu ngẫu nhiên, mù đôi, kiểm soát hoạt động, nghiên cứu trong 5 tuần đã so sánh hiệu quả điều trị của cả hai loại kem thông qua ứng dụng hai lần một ngày. Thử nghiệm lâm sàng được tài trợ bởi NeoStrata Company, Inc.
Không có nghiên cứu nào được hoàn thành để đánh giá tiềm năng gây ung thư hoặc gây ung thư của desonide. Ngoài ra, không có nghiên cứu nào được hoàn thành để xác định ảnh hưởng đến khả năng sinh sản.[2] Đây là những cơ hội hiện tại để cải thiện để tìm hiểu thêm về những rủi ro và lợi ích liên quan đến desonide.
Quy định sửa
Mỹ đầu tiên. bằng sáng chế cho desonide là US4185100A được cấp vào ngày 22 tháng 1 năm 1980.[12] Bằng sáng chế là để điều trị chống viêm tại chỗ bằng cách sử dụng desonide. Bằng sáng chế bảo vệ sự phù hợp của thuốc chống viêm trong điều trị rối loạn da hoặc rối loạn đặc trưng bởi viêm da và/hoặc hoạt động tăng sinh trong lớp biểu bì. Tác dụng phụ và cơ chế hoạt động đều được tiết lộ. Bằng sáng chế này hiện đã hết hạn.
Giá cả sửa
Kem bôi và thuốc mỡ Desonide được bán trong 15g và 60g ống% 0,05 gel, và kem dưỡng da desonide được bán trong 2 chai chất lỏng.[13] Một tuýp 60g hoặc một (1) chai kem dưỡng da có giá tới 200 đô la.
Tham khảo sửa
- ^ Wong, Vicky Kwan; Brian Fuchs; Mark Lebwohl (2004). “Overview on desonide 0.05%: a clinical safety profile”. Journal of Drugs in Dermatology: JDD. 3 (4): 393–7. PMID 15303783.
- ^ a b c d “Access Data FDA” (PDF). FDA.gov. Truy cập ngày 1 tháng 12 năm 2015.
- ^ “desonide topical: Uses, Side Effects, Interactions, Pictures, Warnings & Dosing - WebMD”. WebMD (bằng tiếng Anh). Truy cập ngày 30 tháng 11 năm 2015.
- ^ “Desonate (desonide) - Drug information from MediLexicon”. www.medilexicon.com. Bản gốc lưu trữ ngày 8 tháng 12 năm 2015. Truy cập ngày 30 tháng 11 năm 2015.
- ^ “Desonide topical Drug Interactions - Drugs.com”. Drugs.com (bằng tiếng Anh). Truy cập ngày 12 tháng 7 năm 2018.
- ^ Sittig, Marshall (1988). “Pharmaceutical Manufacturing Encyclopedia” (PDF). Noyes Publications. Bản gốc (PDF) lưu trữ ngày 23 tháng 10 năm 2007. Truy cập ngày 1 tháng 12 năm 2015.
- ^ “Verdeso (desonide) FDA Approval History - Drugs.com”. www.drugs.com. Truy cập ngày 1 tháng 12 năm 2015.
- ^ “Desonate (desonide) FDA Approval History - Drugs.com”. www.drugs.com. Truy cập ngày 1 tháng 12 năm 2015.
- ^ Jorizzo, J (tháng 7 năm 1995). “Multicenter trial for long-term safety and efficacy comparison of 0.05% desonide and 1% hydrocortisone ointments in the treatment of atopic dermatitis in pediatric patients”. Journal of the American Academy of Dermatology. doi:10.1016/0190-9622(95)90014-4.
- ^ “Tridesilon Topical Cream 0.05pct Drug Medication Dosage Information”. www.cvs.com. Truy cập ngày 1 tháng 12 năm 2015.
- ^ “A clinical trial to evaluate treatments using Desonide Cream and Amino Acid Moisturizing Cream for patients with Eczema or Atopic Dermatitis | Clinical Research Trial Listing (Dermatitis, Atopic, Eczema) (NCT02286700)”. www.centerwatch.com. Truy cập ngày 1 tháng 12 năm 2015.
- ^ “Google Patents”. patents.google.com. Truy cập ngày 1 tháng 12 năm 2015.
- ^ Drugs.com: Topical Desonide