Hydro fluoride
Hydro fluoride là một hợp chất hóa học với công thức hoá học HF. Loại khí hoặc chất lỏng không màu này là nguồn fluor công nghiệp chính, thường là dung dịch nước gọi là acid hydrofluoric. Đây là một nguyên liệu quan trọng trong việc chế biến nhiều hợp chất quan trọng bao gồm dược phẩm và polyme (ví dụ như Tefluorn). HF được sử dụng rộng rãi trong ngành công nghiệp hoá dầu như là một thành phần của các chất siêu acid. Hydro fluoride sôi ở nhiệt độ phòng, cao hơn nhiều so với các hydro halide khác. Không giống như các hydro halide khác, HF nhẹ hơn không khí.
| Hydro fluoride | |||
|---|---|---|---|
| |||
 | |||
| Tên khác | Fluoran | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| KEGG | |||
| ChEBI | |||
| Số RTECS | MW7875000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| UNII | |||
| Thuộc tính | |||
| Công thức phân tử | HF | ||
| Khối lượng mol | 20,00634 g/mol | ||
| Bề ngoài | khí hoặc chất lỏng không màu (dưới 19.5°C) | ||
| Khối lượng riêng | 1,15 g/L, gas (25 °C) 0.99 g/mL, liquid (19.5 °C) | ||
| Điểm nóng chảy | −83,6 °C (189,6 K; −118,5 °F) | ||
| Điểm sôi | 19,5 °C (292,6 K; 67,1 °F) | ||
| Độ hòa tan trong nước | miscible | ||
| Áp suất hơi | 783 mmHg (20 °C) | ||
| Độ axit (pKa) | 3.17[1][2] | ||
| Chiết suất (nD) | 1,00001 | ||
| Cấu trúc | |||
| Hình dạng phân tử | Linear | ||
| Mômen lưỡng cực | 1.86 D | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH | −13,66 kJ/g (gas) −14.99 kJ/g (liquid) | ||
| Entropy mol tiêu chuẩn S | 8,687 J/g K (gas) | ||
| Các nguy hiểm | |||
| NFPA 704 |
| ||
| PEL | TWA 3 ppm | ||
| LC50 | 1276 ppm (rat, 1 hr) 1774 ppm (monkey, 1 hr) 4327 ppm (guinea pig, 15 min)[3] | ||
| REL | TWA 3 ppm (2.5 mg/m³) C 6 ppm (5 mg/m³) [15-minute] | ||
| IDLH | 30 ppm | ||
| Các hợp chất liên quan | |||
| Anion khác | Hydro chloride Hydro bromide Hydro iodide Hydrogen astatide | ||
| Cation khác | Natri fluoride Kali fluoride Rubidi fluoride Caesi fluoride | ||
| Hợp chất liên quan | Nước Ammonia | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Hydro fluoride là một loại khí nguy hiểm, tạo thành acid hydrofluoric ăn mòn và xâm nhập khi tiếp xúc với độ ẩm. Loại khí này cũng có thể gây ra chứng mù do sự hủy hoại nhanh chóng của giác mạc.
Nhà hoá học người Pháp Edmond Frémy (1814-1894) được cho là đã phát hiện ra hydro fluoride khan trong khi cố gắng cô lập fluor. Mặc dù Carl Wilhelm Scheele chuẩn bị acid hydrofluoric với số lượng lớn vào năm 1771, acid này đã được biết đến trong ngành công nghiệp thủy tinh trước đó.
Cấu trúc sửa
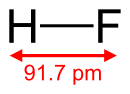
Mặc dù một phân tử diatomic, HF tạo thành các liên kết hydro liên phân tử tương đối mạnh. HF thể rắn bao gồm chuỗi zigzag của các phân tử HF. Các phân tử HF, có liên kết H-F ngắn 95 pm, được liên kết với các phân tử lân cận bằng khoảng cách H-F liên phân tử từ 155 pm[4]. HF lỏng cũng bao gồm các chuỗi các phân tử HF, nhưng các chuỗi là ngắn hơn, bao gồm trung bình chỉ có năm hoặc sáu phân tử[5].
So sánh với các hydro halide khác sửa
Hydro fluoride không đun sôi cho đến 20 °C tương phản với các hydro halide nặng hơn sôi ở nhiệt độ−85 °C (−120 °F) và −35 °C (−30 °F).[6][7][8] Sự liên kết hydro giữa các phân tử HF làm tăng độ nhớt trong pha lỏng và áp suất thấp hơn dự kiến trong pha khí.
Hydro fluoride có thể hoà trộn với nước (tan trong bất kỳ tỷ lệ nào), trong khi các hydro halide khác có khoảng cách hòa tan lớn với nước. Hydro fluoride và nước cũng tạo thành một số hợp chất trong trạng thái rắn, đáng chú ý là hợp chất 1: 1 không tan tới -40 °C (-40 °F), cao hơn nhiệt độ nóng chảy 44 °C (79 °F) Của HF nguyên chất[9].
Độ acid sửa
Không giống các acid haloghalic khác, chẳng hạn như acid chlorhydric, hydro fluoride chỉ là một acid yếu trong dung dịch pha loãng[10]. Đây là một phần kết quả của sức mạnh của liên kết hydrogen-fluor, mà còn với các yếu tố khác như xu hướng các anion HF, H
2O, và F−
tạo thành cụm[12]. Ở nồng độ cao, các phân tử HF đi qua homo để tạo thành các ion đa chức năng (như bifluoride, HF-
2) và proton, do đó làm tăng độ acid[13]. Điều này dẫn đến proton hóa các acid rất mạnh như hydrochloric, sulfuric, hoặc nitric khi sử dụng dung dịch acid fluorfluoric tập trung. Mặc dù acid hydrofluoric được coi là một acid yếu, nó rất ăn mòn, ngay cả khi tấn công kính khi ngậm nước[13].
Độ acid của các dung dịch acid hydrofluoric thay đổi theo nồng độ do các tương tác liên kết hydro của ion fluoride. Dung dịch pha loãng có tính acid yếu với hằng số ion hóa acid Ka = 6.6x10-4 (hoặcpKa = 3.18),[14] tương phản với các dung dịch tương ứng của các hydrohalogen khác là acid mạnh (pKa <0). Các dung dịch cô đặc của hydro fluoride có tính acid cao hơn nhiều so với hàm ý của giá trị này, như được biểu diễn bằng hàm lượng acid Hammett H0[15] (hoặc "pH hiệu quả"). H0 cho 100% HF được ước tính từ -10,2 đến -11, tương đương với giá trị -12 đối với acid sulfuric[16][17].
Trong các thuật ngữ nhiệt động lực học, các giải pháp HF rất không lý tưởng, với hoạt động của HF tăng nhanh hơn nhiều so với nồng độ của nó. Độ acid yếu trong dung dịch pha loãng đôi khi được cho là do sức bền liên kết H-F cao kết hợp với êlê hoà tan cao của HF để lớn hơn so với enthalpy tiêu cực của hydrat hóa của ion fluoride[18]. Tuy nhiên, Giguère và Turrell[19][20] đã chỉ ra bằng phổ hồng ngoại rằng các chất tan chủ yếu là cặp ion liên kết hydro [H3O + · F-], cho thấy rằng sự ion hóa này có thể được mô tả như là một sự cân bằng liên tiếp:
- H2O + HF Bản mẫu:EqmR [H3O+·F−]
- [H3O+·F−] Bản mẫu:EqmL H3O+ + F−
Tham khảo sửa
- ^ “pKa's of Inorganic and Oxo-Acids” (PDF). Harvard. Bản gốc (PDF) lưu trữ ngày 11 tháng 8 năm 2015. Truy cập ngày 9 tháng 9 năm 2013.
- ^ Bruckenstein, S.; Kolthoff, I.M., in Kolthoff, I.M.; Elving, P.J. Treatise on Analytical Chemistry, Vol. 1, pt. 1; Wiley, NY, 1959, pp. 432-433.
- ^ “Hydrogen fluoride”. Nguy hiểm ngay lập tức đến tính mạng hoặc sức khỏe. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ Johnson, M. W.; Sándor, E.; Arzi, E. (1975). “The Crystal Structure of Deuterium Fluoride”. Acta Crystallographica. B31 (8): 1998–2003. doi:10.1107/S0567740875006711.
- ^ Mclain, Sylvia E.; Benmore, CJ; Siewenie, JE; Urquidi, J; Turner, JF (2004). “On the Structure of Liquid Hydrogen Fluoride”. Angewandte Chemie, International Edition. 43 (15): 1952–55. doi:10.1002/anie.200353289. PMID 15065271.
- ^ Pauling, Linus A. (1960). The nature of the chemical bond and the structure of molecules and crystals: An introduction to modern structural chemistry. Cornell University Press. tr. 454–464. ISBN 978-0-8014-0333-0.
- ^ Atkins, Peter; Jones, Loretta (2008). Chemical principles: The quest for insight. W. H. Freeman & Co. tr. 184–185. ISBN 978-1-4292-0965-6.
- ^ Emsley, John (1981). “The hidden strength of hydrogen”. New Scientist. 91 (1264): 291–292. Bản gốc lưu trữ ngày 22 tháng 7 năm 2023. Truy cập ngày 25 tháng 12 năm 2012.
- ^ Greenwood & Earnshaw 1998, tr. 812–816.
- ^ Wiberg, Wiberg & Holleman 2001, tr. 425.
- ^ Clark, Jim (2002). “The acidity of the hydrogen halides”. Truy cập ngày 4 tháng 9 năm 2011.
- ^ Để có giải thích chi tiết xin hãy xem [11]
- ^ a b Chambers, C.; Holliday, A. K. (1975). Modern inorganic chemistry (An intermediate text) (PDF). The Butterworth Group. tr. 328–329. Bản gốc (PDF) lưu trữ ngày 27 tháng 12 năm 2015. Truy cập ngày 20 tháng 4 năm 2017.
- ^ Ralph H. Petrucci; William S. Harwood; Jeffry D. Madura (2007). General chemistry: principles and modern applications. Pearson/Prentice Hall. tr. 691. ISBN 978-0-13-149330-8. Truy cập ngày 22 tháng 8 năm 2011.
- ^ Hyman HH, Kilpatrick M, Katz JJ (1957). “The Hammett Acidity Function H0for Hydrofluoric Acid Solutions1”. Journal of the American Chemical Society. 79 (14): 3668–3671. doi:10.1021/ja01571a016. ISSN 0002-7863.
- ^ W.L. Jolly "Modern Inorganic Chemistry" (McGraw-Hill 1984), p. 203 ISBN 0-07-032768-8
- ^ F. A. Cotton and G. Wilkinson, Advanced Inorganic Chemistry (5th ed.) John Wiley and Sons: New York, 1988. ISBN 0-471-84997-9 p. 109
- ^ C.E. Housecroft and A.G. Sharpe "Inorganic Chemistry" (Pearson Prentice Hall, 2nd ed. 2005), p. 170.
- ^ Giguère, Paul A.; Turrell, Sylvia (1980). “The nature of hydrofluoric acid. A spectroscopic study of the proton-transfer complex H3O+...F−”. J. Am. Chem. Soc. 102 (17): 5473. doi:10.1021/ja00537a008.
- ^ Radu Iftimie; Vibin Thomas; Sylvain Plessis; Patrick Marchand; Patrick Ayotte (2008). “Spectral Signatures and Molecular Origin of Acid Dissociation Intermediates”. J. Am. Chem. Soc. 130 (18): 5901–7. doi:10.1021/ja077846o. PMID 18386892.