Kali peroxide
(Đổi hướng từ Kali peroxit)
Kali peroxide là một hợp chất vô cơ với công thức hóa học K2O2. Nó được hình thành khi kali phản ứng với oxy trong không khí, tạo ra cùng với kali oxit (K2O) và Kali superoxide (KO2).
| Kali peroxide | |
|---|---|
 Cấu trúc của kali peroxide | |
| Danh pháp IUPAC | Kali peroxide |
| Tên khác | "Kali monoxit" |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | K2O2 |
| Khối lượng mol | 110,1954 g/mol |
| Bề ngoài | Chất rắn vô định hình màu vàng |
| Khối lượng riêng | 2,4 g/cm³[1] |
| Điểm nóng chảy | 490 °C (763 K; 914 °F) |
| Điểm sôi | |
| Độ hòa tan trong nước | phản ứng với nước[2] |
| Cấu trúc | |
| Cấu trúc tinh thể | Trực thoi |
| Nhóm không gian | Cmce, oS16,64, α = 90°, β = 90°, γ = 90°[1] |
| Hằng số mạng | a = 0,6733 nm, b = 0,6996 nm, c = 0,6474 nm[1] |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH | -496 kJ·mol-1[3] |
| Entropy mol tiêu chuẩn S | 113 J·mol-1·K−1[3] |
| Các nguy hiểm | |
| Nguy hiểm chính | độc |
| NFPA 704 |
|
| Các hợp chất liên quan | |
| Anion khác | Kali oxit Kali superoxide Kali ozonit |
| Cation khác | Lithi peroxide Natri peroxide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
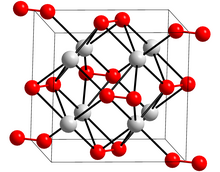
Cấu trúc sửa
K2O2 có các hằng số mạng tinh thể a = 0,6733 nm, b = 0,6996 nm, c = 0,6474 nm, α = 90°, β = 90°, γ = 90°.[1]
Tính chất hóa học sửa
Kali peroxide phản ứng với nước để tạo thành kali hydroxide và oxy:
- 2K2O2 + 2 H2O → 4 KOH + O2
Tham khảo sửa
- ^ a b c d Handbook… (Pierre Villars, Karin Cenzual, Roman Gladyshevskii; Walter de Gruyter GmbH & Co KG, 24 thg 7, 2017 - 1970 trang), trang 121. Truy cập 7 tháng 4 năm 2021.
- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (ấn bản 87). Boca Raton, Florida: CRC Press. tr. 477, 520. ISBN 0-8493-0594-2.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. tr. A22. ISBN 0-618-94690-X.
