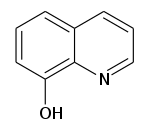
8-Hydroxyquinoline
8-Hydroxyquinoline (còn gọi là oxine) là một tác nhân tạo chelat đã được sử dụng để xác định định lượng các ion kim loại.
| |
| |
| Names | |
|---|---|
| IUPAC name
Quinolin-8-ol, 8-Quinolinol
| |
| Other names
1-azanaphthalene-8-ol, Fennosan H 30, hydroxybenzopyridine, hoxybenzopyridine, oxychinolin, oxyquinoline, phenopyridine, quinophenol, oxine
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.005.193 |
| KEGG | |
PubChem <abbr title="<nowiki>Compound ID</nowiki>">CID
|
|
| UNII |
|
CompTox Dashboard (<abbr title="<nowiki>U.S. Environmental Protection Agency</nowiki>">EPA)
|
|
| |
| |
| Properties | |
| C9H7NO | |
| Molar mass | 145.16 g/mol |
| Appearance | White crystalline needles |
| Density | 1.034 g/cm³ |
| Melting point | 76 °C (169 °F; 349 K) |
| Boiling point | 276 °C (529 °F; 549 K) |
| Pharmacology | |
| G01AC30 (WHO) A01AB07 (WHO) D08AH03 (WHO) R02AA14 (WHO) | |
| Hazards | |
| Main hazards | flammable |
| Safety data sheet | External MSDS |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |

Trong dung dịch nước 8-Hydroxyquinoline có pKa giá trị ca. 9,9 [2] Nó phản ứng với các ion kim loại, làm mất proton và tạo thành phức hợp 8-Hydroxyquinolinato-chelate.
Tổ hợp nhôm [3] là thành phần phổ biến của điốt phát quang hữu cơ (OLED). Biến thể trong các nhóm thế trên các vòng quinoline ảnh hưởng đến tính chất phát quang của nó.[4]
Trong các đồng phân zwitterionic trạng thái kích thích cảm ứng được hình thành trong đó nguyên tử hydro được chuyển từ oxy sang nitơ.[5]
Các phức chất cũng như bản thân dị vòng thể hiện tính chất sát trùng, khử trùng và thuốc trừ sâu,[6][7] hoạt động như một chất ức chế phiên mã.[8] Dung dịch của nó trong rượu được sử dụng trong băng lỏng. Nó từng được quan tâm như một loại thuốc chống ung thư.[9]
Một chất tương tự thiol, 8-Mercaptoquinoline cũng được biết đến.[10]
Rễ cây xâm lấn Centaurea diffusa giải phóng 8-hydroxyquinoline, có tác động tiêu cực đến những cây không cùng tiến hóa với nó.[11]
Tham khảo sửa
- ^ Cölle, M.; Dinnebier, R. E.; Brütting, W. (2002). “The structure of the blue luminescent δ-phase of tris(8-hydroxyquinoline)aluminium(III) (Alq3)”. Chemical Communications. 2002 (23): 2908–9. doi:10.1039/b209164j. PMID 12478807.
- ^ Albert, A.; Phillips, J. N. (1956). “264. Ionization Constants of Heterocyclic Substances. Part II. Hydroxy-Derivatives of Nitrogenous Six-Membered Ring-Compounds”. Journal of the Chemical Society (Resumed). 1956: 1294–1304. doi:10.1039/JR9560001294.
- ^ Katakura, R.; Koide, Y. (2006). “Configuration-Specific Synthesis of the Facial and Meridional Isomers of Tris(8-hydroxyquinolinate)aluminum (Alq3)”. Inorganic Chemistry. 45 (15): 5730–5732. doi:10.1021/ic060594s. PMID 16841973.
- ^ Montes, V. A.; Pohl, R.; Shinar, J.; Anzenbacher, P. Jr. (2006). “Effective Manipulation of the Electronic Effects and Its Influence on the Emission of 5-Substituted Tris(8-quinolinolate) Aluminum(III) Complexes”. Chemistry: A European Journal. 12 (17): 4523–4535. doi:10.1002/chem.200501403. PMID 16619313.
- ^ Bardez, E.; Devol, I.; Larrey, B.; Valeur, B. (1997). “Excited-State Processes in 8-Hydroxyquinoline: Photoinduced Tautomerization and Solvation Effects”. The Journal of Physical Chemistry B. 101 (39): 7786–7793. doi:10.1021/jp971293u.
- ^ Phillips, J. P. (1956). “The Reactions of 8-Quinolinol”. Chemical Reviews. 56 (2): 271–297. doi:10.1021/cr50008a003.
- ^ “8-Hydroxyquinoline”. Medical Dictionary Online. Bản gốc lưu trữ ngày 9 tháng 10 năm 2016. Truy cập ngày 28 tháng 6 năm 2019.
- ^ “8-Hydroxyquinoline”. Sigma-Aldrich. Truy cập ngày 23 tháng 5 năm 2012.
- ^ Shen, A. Y.; Wu, S. N.; Chiu, C. T. (1999). “Synthesis and Cytotoxicity Evaluation of some 8-Hydroxyquinoline Derivatives”. Journal of Pharmacy and Pharmacology. 51 (5): 543–548. doi:10.1211/0022357991772826. PMID 10411213.
- ^ Fleischer, Holger "Structural chemistry of complexes of (n - 1)d10nsm metal ions with β-N-donor substituted thiolate ligands (m=0, 2)" Coordination Chemistry Reviews 2005, volume 249, pp. 799-827. doi:10.1016/j.ccr.2004.08.024
- ^ Vivanco, J.M.; Bais, H.P.; Stermitz, F.R.; Thelen, G.C.; Callaway, R.M. (2004). “Biogeographical variation in community response to root allelochemistry: novel weapons and exotic invasion”. Ecology Letters. 7 (4): 285–292. doi:10.1111/j.1461-0248.2004.00576.x.