Hydroperoxyl
Gốc tự do hydroperoxyl, còn gọi với tên hệ thống là hydro superoxide là dạng superoxide được proton hóa với công thức hóa học là HO2. Gốc tự do này đóng một vai trò quan trọng trong khí quyển và trong sinh học tế bào.[2]

| |
| |
| Danh pháp | |
|---|---|
| Danh pháp IUPAC Hydroperoxyl | |
| Tên hệ thống Hydro superoxide | |
| Danh pháp khác Gốc tự do Peroxyl
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| 506 | |
PubChem <abbr title="<nowiki>Compound ID</nowiki>">CID
|
|
| |
| Tính chất | |
| Công thức hóa học | HO2 |
| Khối lượng mol | 33.006 g·mol−1 |
| pKa | 4.88[1] |
| pKb | 9.12 (dạng ion superoxide) |
| base liên hợp | ion superOxide |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox references | |
Cấu trúc và phản ứng sửa
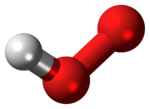
Phân tử có cấu trúc góc.[3]
Các anion superOxide, O−
2, và gốc tự do hydroperoxyl tồn tại ở trạng thái cân bằng trong dung dịch nước:
- O−
2 + H2O ⇌ HO2 + OH−
pKa của HO2 là 4,88. Do đó, khoảng 0,3% superoxide có trong chất nguyên sinh của một tế bào điển hình ở dạng proton.[4]
HO2 oxy hóa nitơ monOxide thành nitơ dioxide:[2]
- NO + HO2 → NO2 + HO
Loài oxy phản ứng trong sinh học sửa
Hydroperoxyl và base liên hợp dạng superOxide là tác nhân hoạt động hóa oxi (reactive oxygen species) rất quan trọng. Nếu O−
2 có tính khử thì HO2 có thể hoạt động như một chất oxy hóa trong một số phản ứng quan trọng về mặt sinh học, chẳng hạn như tách các nguyên tử hydro từ tocopherol và axit béo không bão hòa đa trong lớp lipid kép. Như vậy, HO2 là chất khơi mào quan trọng của quá trình peroxy hóa lipid.
Tầm quan trọng của hóa học khí quyển sửa
Hydroperoxyl dạng khí tham gia vào các chu kỳ phản ứng phá hủy tầng bình lưu. HO2 cũng có mặt trong tầng đối lưu, nơi HO2 thực chất là sản phẩm phụ của quá trình oxy hóa cacbon monoxide và hydrocarbon bởi gốc tự do hydroxyl.[5]
Do hằng số điện môi có tác động mạnh đến pK a và hằng số điện môi của không khí khá thấp, superOxide được tạo ra (từ phản ứng quang hóa) trong khí quyển hầu như chỉ có gốc HO2. Vì HO2 phản ứng khá mạnh nên nó được coi là "chất tẩy rửa" bầu khí quyển bằng cách làm giảm lượng chất hữu cơ gây ô nhiễm có trong không khí. Như vậy, tính chất hóa học của HO2 có vai trò quan trọng trong ngành địa hóa học.
Tham khảo sửa
- ^ "Reactivity of HO2/O−
2 Radicals in Aqueous Solution". J. Phys. Chem. Ref. Data. 14 (4): 1041–1091. 1985. - ^ a b Heard, Dwayne E.; Pilling, Michael J. (2003). “Measurement of OH and HO2 in the Troposphere”. Chemical Reviews. 103: 5163–5198. doi:10.1021/cr020522s.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Liskow, Dean H.; Schaefer, Henry F., III; Bender, Charles F. (1971). “Geometry and electronic structureof the hydroperoxyl Radical”. Journal of the American Chemical Society. 93: 6734–7. doi:10.1021/ja00754a003.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ De Grey, Aubrey D. N. J. (2002). “HO2·: The Forgotten Radical”. DNA and Cell Biology. 21: 251–257. doi:10.1089/104454902753759672.
- ^ “Hydroperoxyl radical”. Glossary of Meteorology. American Meteorological Society. ngày 25 tháng 4 năm 2012. Truy cập ngày 22 tháng 8 năm 2013.