Hydroxyprogesterone caproate
Hydroxyprogesterone caproate (OHPC), được bán dưới tên thương hiệu Proluton và Makena, là một loại thuốc proestin được sử dụng để ngăn ngừa sinh non ở phụ nữ mang thai có tiền sử bệnh và điều trị rối loạn phụ khoa.[1][3][8][9][10] Nó cũng đã được điều chế kết hợp với estrogen cho các chỉ định khác nhau (tên thương hiệu Gravibinon và Primosiston) và là một hình thức kiểm soát sinh sản tiêm lâu dài (tên thương hiệu Chinese Injectable No. 1).[11] Nó không được sử dụng bằng miệng và thay vào đó được tiêm bằng cơ bắp hoặc mỡ, thường là một lần mỗi tuần đến một lần mỗi tháng tùy theo chỉ định.[1][3][4]
 | |
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Delalutin, Proluton, Proluton Depot, Makena, others |
| Đồng nghĩa | OHPC; Hydroxyprogesterone capronate; Hydroxyprogesterone hexanoate; 17α-Hydroxyprogesterone caproate; 17α-OHPC; 17-Hydroxyprogesterone caproate; 17-OHPC; 17-HPC; 17α-HPC; HPC; LPCN-1107; 17α-Hydroxypregn-4-ene-3,20-dione 17α-hexanoate |
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | • Intramuscular injection[1] • Subcutaneous autoinjection[2][3] |
| Mã ATC | |
| Dữ liệu dược động học | |
| Sinh khả dụng | Oral: Very low (~3% in rats)[4] Intramuscular: 100% (in rats)[4] |
| Liên kết protein huyết tương | Extensive (to albumin, not to CBG or (likely) SHBG)[1][5][6] |
| Chuyển hóa dược phẩm | Reduction và hydroxylation (via CYP3A4, CYP3A5, CYP3A7) and conjugation (glucuronidation, sulfation, acetylation)[1] |
| Chu kỳ bán rã sinh học | Non-pregnant: 7.8 days[7][8] Singlet: 16–17 days[1][9] Twins: 10 days[9] |
| Bài tiết | Feces: 50%[1] Urine: 30%[1] |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| ECHA InfoCard | 100.010.127 |
| Dữ liệu hóa lý | |
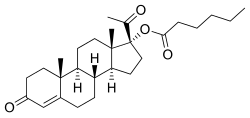
| Công thức hóa học | C27H40O4 |
| Khối lượng phân tử | 428.604 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
OHPC thường được dung nạp tốt và tạo ra ít tác dụng phụ.[1] Phản ứng tại chỗ tiêm như đau và sưng là tác dụng phụ phổ biến nhất của OHPC.[1] Thuốc có thể làm tăng nguy cơ mắc bệnh tiểu đường thai kỳ khi sử dụng ở phụ nữ mang thai.[1][12] OHPC là một progestin, hoặc một tổng hợp progestogen, và do đó là một chất chủ vận của thụ thể progesterone, các mục tiêu sinh học của progestogen như progesterone.[12] Nó có một số hoạt động antimineralocorticoid và không có hoạt động nội tiết tố quan trọng khác.[13][14][15][16][17] Thuốc cho thấy một số khác biệt từ progesterone tự nhiên.[12][18]
OHPC được phát hiện vào năm 1953 và được giới thiệu sử dụng trong y tế vào năm 1954 hoặc 1955.[19] Nó được bán trên thị trường Hoa Kỳ dưới tên thương hiệu Delalutin và trên khắp châu Âu dưới tên thương hiệu Proluton.[20] Thuốc đã bị ngừng sử dụng tại Hoa Kỳ vào năm 1999.[21] Tuy nhiên, OHPC sau đó đã được giới thiệu lại ở Hoa Kỳ dưới tên thương hiệu Makena để điều trị sinh non vào năm 2011 [22] Do giá tăng rất cao, một cuộc tranh cãi về giá đã xảy ra ở đất nước này.[22] OHPC trước đây có sẵn với chi phí thấp từ các nhà thuốc tây ở Hoa Kỳ, nhưng điều này đã bị cấm vào năm 2016.[22][23][24][25]
Sử dụng trong y tế sửa
Sinh non sửa
Việc sử dụng OHPC trong thai kỳ để ngăn ngừa sinh non ở phụ nữ có tiền sử sinh non trong khoảng từ 20 tuần đến 36 tuần và 6 ngày được Hiệp hội Phòng khám Y khoa dành cho bà mẹ đưa ra vào tháng 5 năm 2012 như là bằng chứng cấp I và III, Đề nghị cấp A.[26] Bằng chứng cấp I đề cập đến một thử nghiệm ngẫu nhiên có kiểm soát được cung cấp đúng cách, và bằng chứng cấp III là hỗ trợ từ ý kiến chuyên gia, trong khi khuyến nghị cấp A cho rằng khuyến nghị được đưa ra dựa trên bằng chứng khoa học tốt và nhất quán. OHPC 250 mg IM hàng tuần tốt nhất là bắt đầu từ 16 Tuần20 cho đến 36 tuần được khuyến nghị. Ở những phụ nữ này, nếu siêu âm cổ tử cung siêu âm rút ngắn xuống <25 mm ở <24 tuần, có thể cung cấp cerclage cổ tử cung. Trong nghiên cứu năm 2013, khuyến cáo hướng dẫn dựa trên,[27] cũng có sự giảm đáng kể tỷ lệ mắc bệnh ở trẻ sơ sinh bao gồm tỷ lệ viêm ruột hoại tử thấp hơn (0 ở nhóm điều trị so với 4 ở nhóm chứng), xuất huyết não thất (4 ở nhóm điều trị) so với 8 trong kiểm soát về nguy cơ tương đối 0,25) và cần oxy bổ sung (14% trong nhóm điều trị so với 24% trong giả dược cho nguy cơ tương đối 0,42). Hơn nữa, nghiên cứu này chứa 463 phụ nữ, 310 người được tiêm. Trong số những phụ nữ này, 9 người có trẻ sơ sinh bị dị tật bẩm sinh (2%), nhưng không có mô hình nhất quán và không có cơ quan nội tạng liên quan.
Kiểm soát sinh sửa
OHPC có sẵn kết hợp với estradiol valerate như một biện pháp tránh thai tiêm kết hợp mỗi tháng một lần ở một số quốc gia.[11][28]
Công dụng khác sửa
OHPC đã được sử dụng để điều trị tăng sản tuyến tiền liệt lành tính ở nam giới, mặc dù bằng chứng về hiệu quả là không đáng kể và không chắc chắn.[29] Nó cũng đã được sử dụng để điều trị ung thư tuyến tiền liệt, với liều 1.500 mg hai lần mỗi tuần.[30][31][32][33] Cơ chế hoạt động của OHPC trong những sử dụng này là ức chế sản xuất androgen tinh hoàn thông qua việc ức chế bài tiết hoocmon luteinizing, là kết quả của hoạt động prodogenogen và antigonadotropic của OHPC.[29] Tuy nhiên, các triệu chứng của suy sinh dục có thể phát triển khi OHPC được sử dụng cho chỉ định này, với hai phần ba nam giới được báo cáo là bất lực.[34]
OHPC đã được sử dụng như một thành phần của liệu pháp hormone nữ tính cho phụ nữ chuyển giới.[35][36][37][38][39]
Liều tiêm bắp theo chu kỳ 150 mg OHPC đã được tìm thấy trong một nghiên cứu có hiệu quả trong điều trị phụ nữ bị mụn trứng cá kéo dài, điều trị, với 84% (64 trên 76) đáp ứng với điều trị và cải thiện triệu chứng "tốt đến tuyệt vời".[40][41]
Các dạng có sẵn sửa
OHPC có sẵn một mình ở dạng ống và lọ 125 và 250 mg/mL dung dịch dầu để tiêm bắp (tên thương hiệu Proluton, Makena).[42][43] Nó cũng có sẵn một mình ở dạng 250 mg/mL autoinjection để sử dụng bằng cách tiêm dưới da (tên thương hiệu Makena).[3]
OHPC là hoặc có sẵn kết hợp với estradiol valerate ở dạng ống và lọ 250 mg/mL OHPC và 5 mg/mL dung dịch dầu estradiol valat để tiêm bắp (tên thương hiệu Gravibinon, Trung Quốc số 1).[44][45][46][47] Thuốc được hoặc có sẵn kết hợp với estradiol benzoate ở dạng ống 125–250 mg OHPC và 10 mg estradiol benzoate trong dung dịch dầu để tiêm bắp (tên thương hiệu Primosiston) là tốt.[48][49][50][51][52] :1045 Ngoài ra, OHPC đã được bán trên thị trường kết hợp với estradiol dipropionate ở dạng 50 mg/mL OHPC và 1 mg/mL estradiol dipropionate (tên thương hiệu EP Hormone Depot) tại Nhật Bản.[53][54]
Chống chỉ định sửa
Chống chỉ định của OHPC bao gồm huyết khối hoặc bệnh huyết khối trước đó hoặc hiện tại, ung thư vú đã biết hoặc nghi ngờ, tiền sử hoặc hiện tại của ung thư nhạy cảm với hoóc môn khác, chảy máu âm đạo bất thường không liên quan đến thai kỳ, vàng da ứ mật của thai kỳ, u gan và tăng huyết áp không kiểm soát.[3] Một vài chống chỉ định tương đối cũng tồn tại đối với OHPC.[3]
Tác dụng phụ sửa
OHPC thường được dung nạp tốt và tạo ra tương đối ít tác dụng phụ.[1] Phản ứng tại chỗ tiêm như đau, đau, sưng, ngứa, bầm tím và vón cục là tác dụng phụ phổ biến nhất của OHPC.[1] Tác dụng phụ của OHPC xảy ra lớn hơn hoặc bằng 2% người dùng bao gồm đau tại chỗ tiêm (34,8%), sưng tại chỗ tiêm (17,1%), nổi mề đay (12,3%), viêm ngứa (7,7%), ngứa vùng tiêm (5,8 %), buồn nôn (5,8%), nốt tại chỗ tiêm (4,5%) và tiêu chảy (2,3%).[3] Tỷ lệ tăng nhiều so với kiểm soát sẩy thai (2,4% so với 0%), thai chết lưu (2,0% so với 1,3%), nhập viện vì sinh non (16,0% so với 13,8%), tiền sản giật hoặc tăng huyết áp thai kỳ (8,8% so với 4,6 %), đái tháo đường thai kỳ (5,6% so với 4,6%),[1][12] và oligohydramnios (3,6% so với 1,3%) đã được quan sát với OHPC trong các thử nghiệm lâm sàng trong đó dùng cho phụ nữ mang thai để tránh sinh non.[3]
Quá liều sửa
Không có báo cáo về quá liều OHPC.[3] Trong trường hợp quá liều, điều trị nên dựa trên các triệu chứng.[3] OHPC đã được nghiên cứu ở người với liều cao từ 2.000 đến 5.000 mg mỗi tuần bằng cách tiêm bắp, không có mối quan tâm an toàn.[17][55][56]
Tương tác sửa
OHPC là không có khả năng ảnh hưởng đến hầu hết các enzyme cytochrome P450 ở nồng độ điều trị.[3] Các nghiên cứu tương tác thuốc chưa được thực hiện với OHPC.[3]
Dược lý sửa
Dược lực học sửa
OHPC có progestogen hoạt động, một số antimineralocorticoid hoạt động, và không có hoạt động hormon quan trọng khác.[8][13][14][15][55]
| Hợp chất | <abbr title="<nowiki>Human recombinant progesterone receptor A</nowiki>">hPR-A | <abbr title="<nowiki>Human recombinant progesterone receptor B</nowiki>">hPR-B | <abbr title="<nowiki>Rabbit uterine progesterone receptor</nowiki>">rbPR | <abbr title="<nowiki>Rabbit thymic glucocorticoid receptor</nowiki>">rbGR | <abbr title="<nowiki>Rabbit uterine estrogen receptor</nowiki>">rbER | |||
|---|---|---|---|---|---|---|---|---|
| Progesterone | 100 | 100 | 100 | <1 | <1 | |||
| 17α-Hydroxyprogesterone | 1 | 1 | 3 | 1 | <1 | |||
| Hydroxyprogesterone caproate | 26 | 30 | 28 | 4 | <1 | |||
| Hydroxyprogesterone axetat | 38 | 46 | 115 | 3 | ? | |||
| Ghi chú: Giá trị là tỷ lệ phần trăm (%). Phối tử tham chiếu (100%) là progesterone cho <abbr title="<nowiki>progesterone receptor</nowiki>">PR, dexamethasone cho <abbr title="<nowiki>glucocorticoid receptor</nowiki>">GR và estradiol cho <abbr title="<nowiki>estrogen receptor</nowiki>">ER. Nguồn: Xem mẫu. | ||||||||
Hoạt động sinh sản sửa
OHPC, còn được gọi là 17α-hydroxyprogesterone caproate, gần với progesterone về cấu trúc và dược lý hơn so với hầu hết các proestin khác, và về cơ bản là một proestogen tinh khiết - nghĩa là một chất chủ vận chọn lọc của thụ thể progesterone (PR) hoạt động nội tiết tố.[16][17] Tuy nhiên, OHPC đã cải thiện dược động học so với progesterone, cụ thể là thời gian dài hơn nhiều với tiêm bắp trong dung dịch dầu.[9][49][57][58]
Quản lý bằng cách tiêm bắp, liều chuyển đổi nội mạc tử cung của OHPC mỗi chu kỳ là 250 đến 500 mg và liều thay thế hàng tuần của OHPC là 250 mg, trong khi liều OHPC hiệu quả trong xét nghiệm chậm kinh nguyệt (Greenblatt) là 25 mg mỗi tuần.[49][58][59] Một liều rụng trứng hiệu quả của OHPC là 500 mg mỗi tháng một lần bằng cách tiêm bắp.[46][60][61] Tuy nhiên, liều OHPC được sử dụng trong các biện pháp tránh thai tiêm kết hợp mỗi tháng một lần là 250 mg, và sự kết hợp này có hiệu quả để ức chế sự rụng trứng tương tự.[46][61] Để so sánh, liều medroxyprogesterone axetat (MPA; 6α-methyl-17α-hydroxyprogesterone acetate), một chất tương tự gần gũi của OHPC, được sử dụng bằng cách tiêm bắp trong dung dịch tiêm truyền vi tiêm trong một tháng 25 mg.[46][60] Người ta cũng nói rằng tiêm bắp, 250 mg OHPC trong dung dịch dầu tương đương với tiềm năng proogenogen đến 50 mg medroxyprogesterone acetate trong huyền phù nước vi tinh thể.[62] Tuy nhiên, cần lưu ý rằng trong khi thời gian bán hủy của OHPC tiêm bắp trong dung dịch dầu ở phụ nữ không mang thai là khoảng 8 ngày,[8] thời gian bán hủy của medroxyprogesterone acetate tiêm bắp trong dịch huyền phù vi tinh thể ở phụ nữ là khoảng 50 ngày [63] OHPC cũng ở một mức độ nào đó ít mạnh hơn so với este hydroxyprogesterone axetat liên quan chặt chẽ hơn (OHPA; 17α-hydroxyprogesterone acetate).[64]
17α-hydroxyprogesterone (OHP) có yếu với progestogen hoạt động, nhưng C17α este hóa kết quả trong hoạt động với progestogen cao hơn.[52] Trong số nhiều loại este khác nhau, este caproate (hexanoate) được tìm thấy có hoạt tính proogenogen mạnh nhất, và điều này là cơ sở cho sự phát triển của OHPC, cũng như các ester proogenogen caproate khác như caproate gestonorone.[52] OHPC là một proestogen mạnh hơn nhiều so với 17α-hydroxyprogesterone, nhưng không có ái lực cao với PR như progesterone.[64] OHPC có khoảng 26% và 30% ái lực của progesterone đối với PR-A và PR-B của con người, tương ứng.[1][64] Thuốc không hiệu quả hơn progesterone trong việc kích hoạt các thụ thể này và khơi gợi sự biểu hiện gen liên quan trong ống nghiệm.[1][64]
Tác dụng antigonadotropic sửa
Do kích hoạt PR, OHPC có tác dụng antigonadotropic, hoặc tạo ra sự ức chế trục não bộ-tuyến yên-buồng trứng,[65][66] và có thể ức chế đáng kể sự tiết gonadotropin và sản xuất hoóc môn sinh dục ở liều đủ cao.[33] Một nghiên cứu cho thấy OHPC bằng cách tiêm bắp với liều 200 mg hai lần mỗi tuần trong hai tuần đầu và sau đó 200 mg mỗi tuần một lần trong 12 tuần không ảnh hưởng đáng kể đến việc bài tiết estrogen qua nước tiểu, hormone luteinizing hoặc hormone kích thích nang trứng ở nam giới bị tăng sản tuyến tiền liệt lành tính.[67] Trong một nghiên cứu khác sử dụng liều OHPC tiêm bắp không xác định, bài tiết testosterone được đánh giá ở một người đàn ông duy nhất và được tìm thấy giảm từ 4.2 mg/ngày đến 2.0 mg/ngày (hoặc khoảng 52%) bằng 6 nhiều tuần điều trị, trong khi bài tiết hormone luteinizing vẫn không thay đổi ở người đàn ông.[16] Gestonorone caproate, một proestin liên quan chặt chẽ với OHPC với tiềm năng lớn hơn gấp 5 đến 10 lần ở người,[68][69] đã được tìm thấy để ức chế nồng độ testosterone 75% với liều 400 mg / tuần ở nam giới bị ung thư tuyến tiền liệt.[70][71] Để so sánh, cắt bỏ tinh hoàn làm giảm nồng độ testosterone xuống 91%.[70] Nhìn chung, proestin có thể ức chế tối đa nồng độ testosterone khoảng 70 đến 80%.[70][71][72][73][74] Tác dụng chống lượng tử của OHPC và do đó ức chế testosterone của nó là cơ sở của việc sử dụng OHPC trong điều trị tăng sản tuyến tiền liệt lành tính và ung thư tuyến tiền liệt ở nam giới.[29][30][32][33] Ức chế nồng độ hormone luteinizing bằng OHPC cũng đã được quan sát thấy ở phụ nữ.[69][75]
Hoạt động của Glucocorticoid sửa
OHPC được cho là không có bất kỳ hoạt động glucocorticoid nào.[17] Theo đó, OHPC đã được tìm thấy không làm thay đổi nồng độ cortisol ở người ngay cả khi dùng liều rất cao bằng cách tiêm bắp. Điều này có liên quan vì các thuốc có hoạt tính glucocorticoid đáng kể ức chế nồng độ cortisol do tăng phản hồi tiêu cực trên trục dưới đồi-tuyến yên-tuyến thượng thận.[42][76][77] OHPC đã được nghiên cứu ở người với liều cao tới 5.000 mg mỗi tuần bằng cách tiêm bắp, với sự an toàn và không có tác dụng glucocorticoid được quan sát.[56] Thuốc không tương tác với thụ thể glucocorticoid; nó có khoảng 4% ái lực của dexamethasone đối với thụ thể glucocorticoid của thỏ.[1][64] Nhưng nó hoạt động như một chất chủ vận từng phần của thụ thể và không có hiệu quả lớn hơn progesterone trong việc kích hoạt thụ thể và khơi gợi biểu hiện gen liên quan trong ống nghiệm.[1][64][78]
Các hoạt động khác sửa
Là một progestogen tinh khiết, OHPC không có androgenic, kháng androgen, estrogen, hoặc glucocorticoid hoạt động.[16][17][79] Sự vắng mặt của hoạt động androgenic và antiandrogenic với OHPC trái ngược với hầu hết các proestin 17 -hydroxyprogesterone -derivative khác.[57][79] Do không có đặc tính androgenic, tương tự progesterone, OHPC không có bất kỳ tác dụng gây quái thai nào đối với thai nhi, khiến nó an toàn khi sử dụng trong thai kỳ.[17] Mặc dù OHPC đã được mô tả là một proestogen tinh khiết, nhưng có bằng chứng cho thấy nó có một số hoạt chất antimineralocorticoid, tương tự như progesterone và 17α-hydroxyprogesterone.[14][15] Không giống như progesterone, OHPC và các chất chuyển hóa của nó không được dự đoán sẽ tương tác với các thụ thể không phải là gen như thụ thể progesterone màng hoặc thụ thể GABAA. [18] Theo đó, OHPC không được cho là có các hoạt động neurosteroid của progesterone hoặc tác dụng an thần liên quan của nó.[18]
Liên quan đến enzyme cytochrome P450, OHPC không ảnh hưởng đến CYP1A, CYP2D6, CYP2C9, hoặc CYP3A4, nhưng là một inducer khiêm tốn của CYP2C19.[9]
Dược động học sửa
| Tham số | Người độc thân | Sinh đôi |
|---|---|---|
| C <sub>tối đa</sub></abbr> (ng / mL) | 22.6 (15.8 Từ27.4) | 17.3 (12 trận27) |
| C <sub>có nghĩa là (0, t)</sub></abbr> (ng / mL) | 16.8 (12.8 Từ22.7) | 12.3 (8.4 Phản18.7) |
| <sub>Máng</sub> C</abbr> (ng / mL) | 14.1 (10 Ném18.1) | 11.2 (4,81616) |
| AUC <sub>0 ăn t</sub></abbr> (ng / mL / ngày) | 117.3 (89.9 Phiên159.1) | 86.1 (59 cạn131) |
| t1/2 (ngày) | 16.2 (10.6 Vang21.0) | 10 (6 trận16) |
| T <sub>tối đa</sub></abbr> (ngày) | 1.0 (1 Tiếng3) | 1.2 (1 Tiếng2) |
| Vd/F (× 10 3) (L) | 56 (25.2 Ảo69.6) | 16,9 (9,124,5) |
| <abbr about="#mwt569" data-mw="{"parts":[{"template":{"target":{"wt":"abbr","href":"./Template:Abbr"},"params":{"1":{"wt":"Cl/F"},"2":{"wt":"Clearance"}},"i":0}}]}" data-ve-no-generated-contents="true" id="mwA0A" title="Clearance" typeof="mw:Transclusion mw:ExpandedAttrs">Cl / F</abbr> (× 10 3) (L) | 2.1 (1.5 Lời2.7) | 1,2 (0,91,7) |
| Chú thích: a = OHPC 250 mg mỗi tuần một lần bằng cách tiêm bắp. Nguồn: [9][80][81] | ||
Hấp thu sửa
Ở động vật, khả dụng sinh học của OHPC khi tiêm bắp là gần 100%, nhưng sinh khả dụng đường uống của nó rất thấp ở mức dưới 3%.[4] Ở phụ nữ, 70 OHPC uống / ngày có hiệu lực nội mạc tử cung tương tự như 70 mg/ngày uống OHPA và 2,5 mg/ngày medroxyprogesterone axetat, chỉ ra rằng OHPC và OHPA đường uống có hiệu lực thấp hơn gần 30 lần so với medroxyprogesterone acetate qua đường uống.[82] Do hiệu lực đường uống thấp, OHPC đã không được sử dụng qua đường uống và thay vào đó được sử dụng bằng cách tiêm bắp.[4] Tuy nhiên, một công thức mới của OHPC (tên mã phát triển LPCN-1107) đang được phát triển và đã được chứng minh là có hiệu quả, mặc dù nó cần dùng hai lần một ngày trong một nghiên cứu lâm sàng.[83][84][85]
Hiệu ứng kho chứa xảy ra khi OHPC được tiêm bắp hoặc tiêm dưới da, do đó thuốc có thời gian tác dụng kéo dài.[2][9] Sau khi tiêm bắp đơn 1.000 mg OHPC ở năm phụ nữ bị ung thư nội mạc tử cung, nồng độ OHPC cao nhất là 27,8 ± 5,3 ng / mL và thời gian đạt nồng độ cực đại là 4,6 ± 1,7 (3-7) ngày [86] Theo dõi 13 tuần sử dụng liên tục 1.000 mg OHPC mỗi tuần, mức độ máng của OHPC là 60,0 ± 14 ng / mL.[86] Các thông số dược động học của 250 mg OHPC mỗi tuần một lần bằng cách tiêm bắp cũng đã được nghiên cứu ở phụ nữ mang thai có thai đơn và đa thai (sinh đôi và sinh ba).[9][80][81] Mức độ ổn định của thuốc đạt được trong vòng 4 đến 12 tuần hành chính ở phụ nữ mang thai.[1] Thời gian tác dụng sinh học lâm sàng của OHPC bằng cách tiêm bắp cũng đã được nghiên cứu ở phụ nữ.[87] Một mũi tiêm bắp từ 65 đến 500 mg OHPC trong dung dịch dầu đã được tìm thấy có thời gian tác dụng từ 5 đến 21 ngày về mặt hiệu quả trong tử cung và nhiệt độ cơ thể ở phụ nữ.[87]
Phân phối sửa
OHPC liên kết rộng rãi với protein huyết tương, trong đó bao gồm albumin.[1] Không giống như progesterone và 17α-hydroxyprogesterone, OHPC có ái lực rất thấp với globulin gắn với corticosteroid (ít hơn 0,01% so với cortisol).[5] Progesterone và 17α-hydroxyprogesterone có ái lực thấp với globulin gắn hormone sinh dục, và vì lý do này, chỉ một phần rất nhỏ trong số chúng (dưới 0,5%) liên kết với protein này trong tuần hoàn.[6]
Chuyển hóa sửa
OHPC dường như được chuyển hóa chủ yếu bởi cytochrome P450 enzym CYP3A4 và CYP3A5.[1] Nó cũng có thể được chuyển hóa bởi CYP3A7 trong gan của thai nhi và nhau thai.[1] Không giống như progesterone, OHPC không được chuyển hóa bởi các enzyme biến đổi steroid truyền thống và không hình thành các chất chuyển hóa tương tự.[18] Sự chuyển hóa của OHPC là bằng cách khử, hydroxyl hóa và liên hợp, bao gồm glucuronidation, sulfation và acetyl hóa.[18] Este caproate của OHPC không bị phân cắt trong quá trình trao đổi chất, vì vậy 17α-hydroxyprogesterone không được hình thành từ OHPC.[18][64] Như vậy, OHPC không phải là tiền chất của 17α-hydroxyprogesterone, cũng không phải progesterone.[18][64]
OHPC đã được phát hiện có thời gian bán hủy là 7,8 ngày khi tiêm bắp trong công thức gốc dầu cho phụ nữ không mang thai.[8] Tổng thời lượng của nó được cho là từ 10 đến 14 ngày, dài hơn nhiều so với thời gian dùng progesterone tiêm bắp trong công thức dầu (2 đến 3 ngày).[40] Ở phụ nữ mang thai, thời gian bán hủy của OHPC dường như dài hơn, khoảng 16 hoặc 17 ngày [1][9] Tuy nhiên, ở những phụ nữ mang thai song sinh thay vì độc thân, thời gian bán hủy của OHPC được tìm thấy ngắn hơn mức này, ở mức 10 ngày [9] OHPC đã được phát hiện ở phụ nữ mang thai lên đến 44 ngày sau liều cuối cùng [9]
Thải trừ sửa
OHPC được thải trừ 50% trong phân và 30% trong nước tiểu khi tiêm bắp cho phụ nữ mang thai.[1] Cả steroid tự do và liên hợp được bài tiết bởi các tuyến này, với các liên hợp nổi bật hơn trong phân.[1]
Con đường sửa
OHPC đã được phát hiện sở hữu dược động học tương tự, bao gồm mức đỉnh, thời gian đến mức đỉnh, mức dưới đường cong (nghĩa là phơi nhiễm toàn bộ) và nửa đời thải trừ, bằng cách tiêm bắp hoặc tiêm tự động dưới da.[2] Tuy nhiên, có tỷ lệ đau tại chỗ tiêm cao hơn khi tự động tiêm dưới da so với tiêm bắp (37,3% so với 8,2%).[2]
Thú y sửa
Dược động học của OHPC trong các động vật móng guốc khác nhau bao gồm gia súc, trâu, cừu và dê đã được nghiên cứu.[88]
Hóa học sửa
OHPC, còn được gọi là 17α-hydroxyprogesterone caproate hoặc như 17α-hydroxypregn-4-ene-3,20-dione 17α-hexanoate, là một tổng hợp pregnane steroid và một phái sinh của progesterone.[20][89] Nó là đặc biệt một dẫn xuất của 17α-hydroxyprogesterone với một hexanoate (caproate) este ở vị trí C17α.[20][89] Chất tương tự của OHPC bao gồm các dẫn xuất khác 17α-hydroxyprogesterone như algestone acetophenide (dihydroxyprogesterone acetophenide), chlormadinone axetat, cyproterone axetat, hydroxyprogesterone axetat, hydroxyprogesterone heptanoate, medroxyprogesterone axetat, và megestrol axetat, cũng như caproate este caproate chlormadinone, gestonorone caproate (norhydroxyprogesterone caproate), medroxyprogesterone caproate, megestrol caproate và methenmadinone caproate.[20][89]
Tổng hợp sửa
Tổng hợp hóa học của OHPC đã được mô tả.[90][91][92] :6
Lịch sử sửa
Cùng với hydroxyprogesterone axetat, OHPC được phát triển bởi Karl Junkmann của Schering AG vào năm 1953 và được báo cáo đầu tiên bởi ông trong tài liệu y khoa vào năm 1954.[93][94][95][96][97] Nó được báo cáo lần đầu tiên bán ở Nhật Bản vào năm 1954 hoặc 1955,[19] và sau đó được giới thiệu là Delalutin ở Hoa Kỳ vào năm 1956.[9][98] Do thời gian dài hơn nhiều so với progesterone tiêm, OHPC đã thay thế phần lớn progesterone trong thực hành lâm sàng vào năm 1975.[99] Sau nhiều thập kỷ sử dụng, Squibb, nhà sản xuất, đã tự nguyện rút sản phẩm Delalutin tại Hoa Kỳ vào năm 1999.[21] Mối quan tâm mới đối với OHPC ở Hoa Kỳ đã được khơi dậy bằng một nghiên cứu lớn do NIH tài trợ năm 2003 cho thấy OHPC làm giảm nguy cơ sinh non ở những phụ nữ mang thai có nguy cơ được lựa chọn.[27] Với dữ liệu theo dõi cho thấy không có bằng chứng về tác dụng có hại đối với con cái, FDA đã phê duyệt loại thuốc này, do KV Dược tài trợ là Makena, là một loại thuốc mồ côi vào tháng 2 năm 2011 để giảm nguy cơ sinh non ở phụ nữ trước khi mang thai 37 tuần với một thai nhi đã sinh ít nhất một lần sinh non trước đó.[22][100]
Xã hội và văn hoá sửa
Tên gốc sửa
Hydroxyprogesterone caproate là tên gốc của OHPC và INN, USAN, BANM và JAN, trong khi hydroxyprogesterone hexanoate là BANM trước đây của nó.[20][28][89]
OHPC thường bị gắn nhãn sai và nhầm lẫn với progesterone và 17α-hydroxyprogesterone.[101] Không nên nhầm lẫn với hydroxyprogesterone axetat, hydroxyprogesterone heptanoate hoặc medroxyprogesterone axetat.[89]
Tên biệt dược sửa
OHPC được bán trên toàn thế giới dưới nhiều tên biệt dược bao gồm Proluton, Proluton Depot và Makena (US), cùng với nhiều biệt dược khác.[20][28][89] Nó cũng trước đây được bán trên thị trường dưới tên thương hiệu bao gồm Delalutin, Prodrox và Hylutin trong số những người khác, nhưng các công thức này đã bị ngưng.[20][89] Nó đã được bán trên thị trường dưới tên thương hiệu Gravibinon và Thuốc tiêm số 1 (hoặc thuốc tiêm số 1 Trung Quốc) kết hợp với estradiol valerate [44][45][46][47] và dưới tên thương hiệu Primosiston kết hợp với estradiol benzoate.[48][49][50][51][52]
Tính khả dụng sửa
OHPC được bán trên thị trường Hoa Kỳ và khắp Châu Âu, Châu Á và Trung và Nam Mỹ.[20][28][102] Nó đáng chú ý là không có sẵn ở Canada, Vương quốc Anh, New Zealand hoặc Nam Phi và chỉ có các công thức thú y có sẵn ở Úc.[20][28][102] OHPC cũng được bán trên thị trường kết hợp với estradiol valerate dưới dạng thuốc ngừa thai tiêm kết hợp ở một số quốc gia bao gồm Nam Mỹ, México, Nhật Bản và Trung Quốc.[20][28][102] Nó đã được bán trên thị trường như là một chế phẩm tiêm kết hợp với estradiol benzoate ở một số nước là tốt.[48][49][50][51][52]
Tranh cãi về giá sửa
Với việc chỉ định OHPC là thuốc mồ côi của FDA và sự chấp thuận của Makena vào năm 2011, giá của OHPC ở Hoa Kỳ sẽ tăng từ 15 đô la Mỹ 1,500 đô la Mỹ cho một liều duy nhất, hoặc từ khoảng 300 đô la Mỹ đến giữa 25,000 đô la Mỹ và 30,000 đô la Mỹ cho một tháng điều trị thông thường.[22] Đây là khoảng tăng gấp 100 lần chi phí, với "lợi ích lâm sàng bổ sung tối thiểu" và là một chiến lược giá bị chỉ trích mạnh mẽ.[22][22] Sau đó, FDA đã tuyên bố rằng các nhà thuốc tây có thể tiếp tục bán OHPC với chi phí thông thường khoảng 10 đô la Mỹ đến 20 đô la Mỹ mỗi liều mà không sợ bị trả thù.[22][23] KV Dược cũng đã chọn giảm giá Makena xuống còn 690 đô la Mỹ mỗi liều.[22][103] OHPC tiếp tục có sẵn với chi phí thấp từ các nhà thuốc tây cho đến cuối năm 2016, sau thời gian đó, FDA đã công bố các tài liệu hướng dẫn mới cấm các nhà thuốc tây bán sản phẩm là "bản sao" của các sản phẩm thuốc có bán trên thị trường.[24][25]
Nghiên cứu sửa
OHPC đã được nghiên cứu bởi Schering để sử dụng như một biện pháp tránh thai tiêm chỉ có proestogen với liều 250 đến 500 mg mỗi tháng một lần bằng cách tiêm bắp nhưng sản xuất kiểm soát chu kỳ kém ở những liều này và không bao giờ được bán trên thị trường.[104][105]
OHPC tự nó đã được tìm thấy có rất ít hoặc không có hiệu quả trong điều trị ung thư vú ở phụ nữ.[52][106][107][108] Ngược lại, sự kết hợp của estradiol valerate và OHPC đã được tìm thấy là có hiệu quả trong điều trị ung thư vú ở phụ nữ.[52][109][110] Nghiên cứu ban đầu dựa trên dữ liệu lâm sàng hạn chế báo cáo rằng tỷ lệ đáp ứng ung thư vú với sự kết hợp của estradiol val Cả và OHPC dường như lớn hơn so với chỉ dùng estrogen (35% so với 50%).[52] Tuy nhiên, nghiên cứu tiếp theo sử dụng progestin gestonorone caproate có liên quan nhưng mạnh hơn cho thấy rằng sự kết hợp giữa estradiol val Cả và gestonorone caproate có hiệu quả không khác biệt đáng kể so với estrogen đơn thuần trong điều trị ung thư vú ở phụ nữ.[111]
Một công thức mới của OHPC (tên mã phát triển LPCN-1107) đang được phát triển để ngăn ngừa chuyển dạ sinh non.[83][84] Kể từ tháng 9 năm 2017, đó là trong các thử nghiệm lâm sàng giai đoạn II hoặc III cho chỉ định này.[83]
Xem thêm sửa
Tham khảo sửa
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y Deeks ED (tháng 10 năm 2011). “17 α-Hydroxyprogesterone caproate (Makena™): in the prevention of preterm birth”. Paediatric Drugs. 13 (5): 337–45. doi:10.2165/11208140-000000000-00000. PMID 21888448.
- ^ a b c d Krop J, Kramer WG (tháng 12 năm 2017). “Comparative Bioavailability of Hydroxyprogesterone Caproate Administered via Intramuscular Injection or Subcutaneous Autoinjector in Healthy Postmenopausal Women: A Randomized, Parallel Group, Open-label Study”. Clinical Therapeutics. 39 (12): 2345–2354. doi:10.1016/j.clinthera.2017.10.020. PMID 29191450.
- ^ a b c d e f g h i j k l https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/021945s012lbl.pdf
- ^ a b c d e Shaik IH, Bastian JR, Zhao Y, Caritis SN, Venkataramanan R (2015). “Route of administration and formulation dependent pharmacokinetics of 17-hydroxyprogesterone caproate in rats”. Xenobiotica; the Fate of Foreign Compounds in Biological Systems. 46 (2): 169–74. doi:10.3109/00498254.2015.1057547. PMC 4809632. PMID 26153441.
- ^ a b Mickelson KE, Forsthoefel J, Westphal U (tháng 10 năm 1981). “Steroid-protein interactions. Human corticosteroid binding globulin: some physicochemical properties and binding specificity”. Biochemistry. 20 (21): 6211–8. doi:10.1021/bi00524a047. PMID 7306509.
- ^ a b Dunn JF, Nisula BC, Rodbard D (tháng 7 năm 1981). “Transport of steroid hormones: binding of 21 endogenous steroids to both testosterone-binding globulin and corticosteroid-binding globulin in human plasma”. The Journal of Clinical Endocrinology and Metabolism. 53 (1): 58–68. doi:10.1210/jcem-53-1-58. PMID 7195404.
- ^ Onsrud M, Paus E, Haug E, Kjørstad K (1985). “Intramuscular administration of hydroxyprogesterone caproate in patients with endometrial carcinoma. Pharmacokinetics and effects on adrenal function”. Acta Obstetricia et Gynecologica Scandinavica. 64 (6): 519–23. doi:10.3109/00016348509156732. PMID 2932883.
- ^ a b c d e Hines M, Lyseng-Williamson KA, Deeks ED (tháng 3 năm 2013). “17 α-hydroxyprogesterone caproate (Makena®): a guide to its use in the prevention of preterm birth”. Clinical Drug Investigation. 33 (3): 223–7. doi:10.1007/s40261-013-0060-6. PMID 23413110.
- ^ a b c d e f g h i j k l Feghali M, Venkataramanan R, Caritis S (tháng 12 năm 2014). “Prevention of preterm delivery with 17-hydroxyprogesterone caproate: pharmacologic considerations”. Seminars in Perinatology. 38 (8): 516–22. doi:10.1053/j.semperi.2014.08.013. PMC 4253874. PMID 25256193.
- ^ Manuck TA (tháng 12 năm 2017). “17-alpha hydroxyprogesterone caproate for preterm birth prevention: Where have we been, how did we get here, and where are we going?”. Seminars in Perinatology. 41 (8): 461–467. doi:10.1053/j.semperi.2017.08.004. PMID 28947068.
- ^ a b Newton JR, D'arcangues C, Hall PE (1994). “A review of "once-a-month" combined injectable contraceptives”. Journal of Obstetrics and Gynaecology. 4 Suppl 1: S1-34. doi:10.3109/01443619409027641. PMID 12290848.
- ^ a b c d Romero R, Stanczyk FZ (tháng 6 năm 2013). “Progesterone is not the same as 17α-hydroxyprogesterone caproate: implications for obstetrical practice”. American Journal of Obstetrics and Gynecology. 208 (6): 421–6. doi:10.1016/j.ajog.2013.04.027. PMC 4120746. PMID 23643669.
- ^ a b Horsky J, Presl J (ngày 6 tháng 12 năm 2012). Ovarian Function and its Disorders: Diagnosis and Therapy. Springer Science & Business Media. tr. 95–. ISBN 978-94-009-8195-9.
- ^ a b c Dorfman RI (ngày 5 tháng 12 năm 2016). Steroidal Activity in Experimental Animals and Man. Elsevier Science. tr. 398–. ISBN 978-1-4832-7299-3.
Intramuscular administration of 17α-hydroxyprogesterone caproate produced signs and symptoms of adrenal insufficiency in Addisonians maintained on cortisol and 9α-fluorocortisol (Melby, 1961) and thereby showed properties similar to progesterone and 17α-hydroxyprogesterone. However, further tests will be required to eludicate its pharmacodynamics properties. Contrastingly, there was no evidence for salt dissipation with the test of a smaller dose of the steroid to normal subjects (Landau et al., 1958).
- ^ a b c Sammour MB, El-Kabarity H, Khalifa AS (1975). “Progesterone therapy in pre-eclamptic toxaemia”. Acta Obstetricia et Gynecologica Scandinavica. 54 (3): 195–202. doi:10.3109/00016347509157760. PMID 1163210.
Melby (14) found that when progesterone was administered to patients suffering from the syndrome of idiopathic oedema, they experienced a diuresis, with a high excretion of sodium and water within 24 hours after a single injection of 500 mg of 17-α-hydroxyprogesterone caproate.
- ^ a b c d Geller J, Bora R, Roberts T, Newman H, Lin A, Silva R (tháng 7 năm 1965). “Treatment of benign prostatic hypertrophy with hydroxyprogesterone caproate: effect on clinical symptoms, morphology, and endocrine function”. JAMA. 193 (2): 121–8. doi:10.1001/jama.1965.03090020035009. PMID 14304354.
- ^ a b c d e f Meis PJ (tháng 5 năm 2005). “17 hydroxyprogesterone for the prevention of preterm delivery”. Obstetrics and Gynecology. 105 (5 Pt 1): 1128–35. doi:10.1097/01.AOG.0000160432.95395.8f. PMID 15863556.
- ^ a b c d e f g Byrns MC (tháng 1 năm 2014). “Regulation of progesterone signaling during pregnancy: implications for the use of progestins for the prevention of preterm birth”. The Journal of Steroid Biochemistry and Molecular Biology. 139: 173–81. doi:10.1016/j.jsbmb.2013.01.015. PMID 23410596.
- ^ a b International Agency for Research on Cancer (1979). Sex Hormones (II). International Agency for Research on Cancer. tr. 401. ISBN 978-92-832-1221-8.
17α-Hydroxyprogesterone caproate was first marketed commercially in Japan in 1954-1955.
- ^ a b c d e f g h i j Index Nominum 2000: International Drug Directory. Taylor & Francis. tháng 1 năm 2000. tr. 532–. ISBN 978-3-88763-075-1.
- ^ a b Kim S. “The Orphan Drug Act: How the FDA Unlawfully Usurped Market Exclusivity”. Northwestern Journal of Technology and Intellectual Property. Heinonline. 11: [, v].
- ^ a b c d e f g h i Armstrong J (tháng 5 năm 2011). “Unintended consequences--the cost of preventing preterm births after FDA approval of a branded version of 17OHP”. The New England Journal of Medicine. 364 (18): 1689–91. doi:10.1056/NEJMp1102796. PMID 21410391.
- ^ a b “Macleans.ca - Canada's national current affairs and news magazine since 1905”. Bản gốc lưu trữ ngày 14 tháng 12 năm 2011. Truy cập ngày 30 tháng 3 năm 2011.
- ^ a b Research, Center for Drug Evaluation and (ngày 1 tháng 4 năm 2019). “Compounded Drug Products That Are Essentially Copies of a Commercially Available Drug Product Under Section 503A of the Federal Food, Drug, and Cosmetic Act Guidance for Industry”. U.S. Food and Drug Administration (bằng tiếng Anh). Truy cập ngày 14 tháng 6 năm 2019.
- ^ a b “FDA to Restrict Compounders from Making Copies of Commercially Available Drugs”. RAPS.com. ngày 7 tháng 7 năm 2016. Truy cập ngày 14 tháng 6 năm 2019.
- ^ SMFM Clinical Guideline: Progesterone and preterm birth prevention: translating clinical trials data into clinical practice, AJOG May 2012
- ^ a b Meis PJ, Klebanoff M, Thom E, Dombrowski MP, Sibai B, Moawad AH, và đồng nghiệp (tháng 6 năm 2003). “Prevention of recurrent preterm delivery by 17 alpha-hydroxyprogesterone caproate”. The New England Journal of Medicine. 348 (24): 2379–85. doi:10.1056/NEJMoa035140. PMID 12802023.
- ^ a b c d e f “Hydroxyprogesterone”.
- ^ a b c Benign Prostatic Hypertrophy. Springer Science & Business Media. ngày 6 tháng 12 năm 2012. tr. 266–. ISBN 978-1-4612-5476-8.
- ^ a b Ablin RJ, Mason MD (ngày 5 tháng 9 năm 2007). Metastasis of Prostate Cancer. Springer Science & Business Media. tr. 286–. ISBN 978-1-4020-5847-9.
- ^ Smith PH (ngày 29 tháng 6 năm 2013). Cancer of the Prostate and Kidney. Springer Science & Business Media. tr. 309, 339. ISBN 978-1-4684-4349-3.
- ^ a b Hafez ES, Spring-Mills E (ngày 6 tháng 12 năm 2012). Prostatic Carcinoma: Biology and Diagnosis. Springer Science & Business Media. tr. 128–. ISBN 978-94-009-8887-3.
- ^ a b c Castro JE (ngày 9 tháng 3 năm 2013). The Treatment of Prostatic Hypertrophy and Neoplasia. Springer Science & Business Media. tr. 39, 132. ISBN 978-94-015-7190-6.
Geller has also demonstrated significant decreases in plasma or urine testosterone glucuronide levels following the administration of three other anti-androgens. These include Delalutin [hydroxyprogesterone caproate], chlormadinone acetate, and PH-218. It would appear that decreased androgen production is a property shared by all anti-androgens to date.
- ^ Aronson JK (ngày 21 tháng 2 năm 2009). Meyler's Side Effects of Endocrine and Metabolic Drugs. Elsevier. tr. 289–. ISBN 978-0-08-093292-7.
- ^ Israel GE, Tarver DE, Shaffer JD (ngày 1 tháng 3 năm 2001). Transgender Care: Recommended Guidelines, Practical Information, and Personal Accounts. Temple University Press. tr. 58–. ISBN 978-1-56639-852-7.
- ^ Ekins R, King D (ngày 23 tháng 10 năm 2006). The Transgender Phenomenon. SAGE Publications. tr. 48–. ISBN 978-1-84787-726-0.
- ^ Adler RK, Hirsch S, Mordaunt M (ngày 1 tháng 5 năm 2012). Voice and Communication Therapy for The Transgender/Transsexual Client: A Comprehensive Clinical Guide. Plural Publishing. tr. 486–. ISBN 978-1-59756-631-5.
- ^ Masumori N (tháng 5 năm 2012). “Status of sex reassignment surgery for gender identity disorder in Japan”. International Journal of Urology. 19 (5): 402–14. doi:10.1111/j.1442-2042.2012.02975.x. PMID 22372595.
- ^ Chekir C, Emi Y, Arai F, Kikuchi Y, Sasaki A, Matsuda M, Shimizu K, Tabuchi K, Kamada Y, Hiramatsu Y, Nakatsuka M (tháng 6 năm 2012). “Altered arterial stiffness in male-to-female transsexuals undergoing hormonal treatment”. The Journal of Obstetrics and Gynaecology Research. 38 (6): 932–40. doi:10.1111/j.1447-0756.2011.01815.x. PMID 22487218.
- ^ a b Baker KC (tháng 11 năm 1958). “Treatment of persistent acne in women with 17 alpha hydroxyprogesterone caproate (delalutin); a preliminary report”. The Journal of Investigative Dermatology. 31 (5): 247–50. doi:10.1038/jid.1958.114. PMID 13598928.
- ^ Antibiotic Medicine and Clinical Therapy. 1959. tr. 249.
- ^ a b Becker KL (2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. tr. 757–759, 2168. ISBN 978-0-7817-1750-2.
- ^ Nema S, Ludwig JD (ngày 19 tháng 4 năm 2016). Pharmaceutical Dosage Forms - Parenteral Medications, Third Edition: Volume 1: Formulation and Packaging. CRC Press. tr. 161–. ISBN 978-1-4200-8644-7.
- ^ a b Muller NF, Dessing RP (ngày 19 tháng 6 năm 1998). European Drug Index: European Drug Registrations . CRC Press. tr. 561–. ISBN 978-3-7692-2114-5.
- ^ a b Garza-Flores J (tháng 4 năm 1994). “Pharmacokinetics of once-a-month injectable contraceptives”. Contraception. 49 (4): 347–59. doi:10.1016/0010-7824(94)90032-9. PMID 8013219.
- ^ a b c d e Sang GW (tháng 4 năm 1994). “Pharmacodynamic effects of once-a-month combined injectable contraceptives”. Contraception. 49 (4): 361–85. doi:10.1016/0010-7824(94)90033-7. PMID 8013220.
- ^ a b Bagade O, Pawar V, Patel R, Patel B, Awasarkar V, Diwate S (2014). “Increasing use of long-acting reversible contraception: safe, reliable, and cost-effective birth control” (PDF). World J Pharm Pharm Sci. 3 (10): 364–392. ISSN 2278-4357.
- ^ a b c Leidenberger FA (ngày 17 tháng 4 năm 2013). Klinische Endokrinologie für Frauenärzte. Springer-Verlag. tr. 533–. ISBN 978-3-662-08110-5.
- ^ a b c d e Knörr K, Beller FK, Lauritzen C (ngày 17 tháng 4 năm 2013). Lehrbuch der Gynäkologie. Springer-Verlag. tr. 214, 255. ISBN 978-3-662-00942-0.
- ^ a b c Kahr H (ngày 8 tháng 3 năm 2013). Konservative Therapie der Frauenkrankheiten: Anzeigen, Grenzen und Methoden Einschliesslich der Rezeptur. Springer-Verlag. tr. 22–. ISBN 978-3-7091-5694-0.
- ^ a b c Kern W, Auterhoff H, Neuwald F, Schmid W (ngày 9 tháng 3 năm 2013). Hagers Handbuch der Pharmazeutischen Praxis: Für Apotheker, Arzneimittelhersteller, Drogisten, Ärzte und Medizinalbeamte. Springer-Verlag. tr. 1163–. ISBN 978-3-642-49759-9.
- ^ a b c d e f g h Ufer, Joachim (1968). “Die therapeutische Anwendung der Gestagene beim Menschen” [Therapeutic Use of Progestogens in Humans]. Die Gestagene [Progestogens]. Springer-Verlag. tr. 1026–1124. doi:10.1007/978-3-642-99941-3_7. ISBN 978-3-642-99941-3.
Depotinjektionen [...] 2. Einmalige Injektion von 125mg oder 250mg 17α-Hydroxyprogesteroncapronat als Depotgestagen und 10 mg Oestradiolbenzoat in öliger Lösung (Primosiston) [47, 81, 110, 563, 523, 571, 718, 721, 732, 733, 864, 872, 933, 973, 400].
- ^ “Bản sao đã lưu trữ”. Bản gốc lưu trữ ngày 7 tháng 4 năm 2019. Truy cập ngày 30 tháng 6 năm 2019.
- ^ Noguchi M, Tajiri K, Taniya T, Kumaki T, Ashikari A, Miyazaki I (1990). “Influence of hormones on proliferation of ER-positive cells and ER-negative cells of human breast cancer (MCF-7)”. Oncology. 47 (1): 19–24. doi:10.1159/000226779. PMID 2137212.
After the transplantation, each mouse received an intramuscular injection of 0.1 ml EP Hormone Depot consisting of 1 mg/ml 17-β-estradiol dipropionate and 50 mg/ml hydroxyprogesterone caproate every week.
- ^ a b Hall NR (tháng 6 năm 2011). “What agent should be used to prevent recurrent preterm birth: 17-P or natural progesterone?”. Obstetrics and Gynecology Clinics of North America. 38 (2): 235–46, ix–x. doi:10.1016/j.ogc.2011.02.014. PMID 21575799.
- ^ a b Varga A, Henriksen E. Clinical and Histopathologic Evaluation of the Effect of 17-alpha-Hydroxyprogesterone-17-n-caproate on Endometrial Carcinoma. Obstetrics & Gynecology. December 1961. Volume 18. Issue 6. pp. 658-672.
- ^ a b Kuhl H (tháng 8 năm 2005). “Pharmacology of estrogens and progestogens: influence of different routes of administration” (PDF). Climacteric. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947.
- ^ a b Knörr K, Knörr-Gärtner H, Beller FK, Lauritzen C (ngày 8 tháng 3 năm 2013). Geburtshilfe und Gynäkologie: Physiologie und Pathologie der Reproduktion. Springer-Verlag. tr. 583–. ISBN 978-3-642-95583-9.
- ^ Lauritzen C (tháng 9 năm 1990). “Clinical use of oestrogens and progestogens”. Maturitas. 12 (3): 199–214. doi:10.1016/0378-5122(90)90004-P. PMID 2215269.
- ^ a b Toppozada MK (tháng 4 năm 1994). “Existing once-a-month combined injectable contraceptives”. Contraception. 49 (4): 293–301. doi:10.1016/0010-7824(94)90029-9. PMID 8013216.
- ^ a b Siegel I (tháng 6 năm 1963). “Conception control by long-acting progestogens: preliminary report”. Obstetrics and Gynecology. 21: 666–8. doi:10.1097/00006250-196306000-00003 (không hoạt động ngày 19 tháng 5 năm 2019). PMID 13992789.Quản lý CS1: DOI không hoạt động tính đến 2019 (liên kết)
- ^ Kistner RW (tháng 12 năm 1960). “The use of progestational agents in obstetrics and gynecology”. Clinical Obstetrics and Gynecology. 3 (4): 1047–67. doi:10.1097/00003081-196003040-00019. PMID 13756432.
50 mg of [medroxyprogesterone acetate], intramuscularly, is equivalent to 250 mg [hydroxyprogesterone caproate]
- ^ “Depo_Provera” (PDF). FDA. 2016. Bản gốc (PDF) lưu trữ 29 Tháng 7 2020. Truy cập ngày 31 tháng 3 năm 2018. Kiểm tra giá trị ngày tháng trong:
|archive-date=(trợ giúp) - ^ a b c d e f g h Attardi BJ, Zeleznik A, Simhan H, Chiao JP, Mattison DR, Caritis SN (tháng 12 năm 2007). “Comparison of progesterone and glucocorticoid receptor binding and stimulation of gene expression by progesterone, 17-alpha hydroxyprogesterone caproate, and related progestins”. American Journal of Obstetrics and Gynecology. 197 (6): 599.e1–7. doi:10.1016/j.ajog.2007.05.024. PMC 2278032. PMID 18060946.
- ^ Yang D, Zhu RL (tháng 4 năm 1994). “[Changes in reproductive hormones levels in the treatment of endometrial precancerous lesion with hydroxyprogesterone caproate]”. Zhonghua Fu Chan Ke Za Zhi (bằng tiếng Trung). 29 (4): 205–6, 251. PMID 8082440.
In this paper, 14 cases of precancerous lesion of endometrium were treated with hydroxyprogesterone caproate and a series of hormone determination was analysed before and after treatment. Results showed that LH and LH/FSH were dramatically decreased. (LH P < 0.05, LH/FSH P < 0.01).
- ^ Benign Prostatic Hypertrophy. Springer Science & Business Media. ngày 6 tháng 12 năm 2012. tr. 266–. ISBN 978-1-4612-5476-8.
Since the initial report by Geller and associates28 on the use of hydroxyprogesterone caproate in the treatment of BPH, a variety of progestins have been studied in the medical management of this disease: hydroxyprogesterone caproate, chlormadinone acetate,27 and medrogestone (6-methyl-6-dehydro-17-methylprogesterone).50 These drugs should have a beneficial effect in BPH as they inhibit testicular function by suppressing serum LH and have no intrinsic estrogenic or androgenic activity.
- ^ Meiraz D, Margolin Y, Lev-Ran A, Lazebnik J (tháng 2 năm 1977). “Treatment of benign prostatic hyperplasia with hydroxyprogesterone-caproate: placebo-controlled study”. Urology. 9 (2): 144–8. doi:10.1016/0090-4295(77)90184-4. PMID 65818.
- ^ Karlstedt K (tháng 4 năm 1971). “Progesterone treatment for local recurrence and metastases in carcinoma corporis uteri”. Acta Radiologica. 10 (2): 187–92. doi:10.3109/02841867109129755. PMID 5556820.
The preparations used were Proluton Depot (17a-hydroxy-progesterone caproate) and in 3 patients SH 5132 (17a-hydroxy-19-norprogesterone caproate); 100 mg of the latter corresponds to 1000 mg of Proluton Depot.
- ^ a b Moe N (1972). “Short-term progestogen treatment of endometrial carcinoma. Histological, histochemical and hormonal studies”. Acta Obstetricia et Gynecologica Scandinavica. 51 (1): 55–62. doi:10.3109/00016347209154968. PMID 4261828.
- ^ a b c Sander S, Nissen-Meyer R, Aakvaag A (1978). “On gestagen treatment of advanced prostatic carcinoma”. Scandinavian Journal of Urology and Nephrology. 12 (2): 119–21. doi:10.3109/00365597809179977. PMID 694436.
- ^ a b Kjeld JM, Puah CM, Kaufman B, Loizou S, Vlotides J, Gwee HM, Kahn F, Sood R, Joplin GF (tháng 11 năm 1979). “Effects of norgestrel and ethinyloestradiol ingestion on serum levels of sex hormones and gonadotrophins in men”. Clinical Endocrinology. 11 (5): 497–504. doi:10.1111/j.1365-2265.1979.tb03102.x. PMID 519881.
Another synthetic gestogen, 17-hydroxy-19-norprogesterone caproate (Depostat-Schering), 400 mg by i.m. weekly injections suppressed T levels to 25% of pretreatment values (Sander er al., 1978).
- ^ Wein AJ, Kavoussi LR, Novick AC, Partin AW, Peters CA (ngày 25 tháng 8 năm 2011). Campbell-Walsh Urology: Expert Consult Premium Edition: Enhanced Online Features and Print, 4-Volume Set. Elsevier Health Sciences. tr. 2938–. ISBN 978-1-4160-6911-9.
- ^ Knuth UA, Hano R, Nieschlag E (tháng 11 năm 1984). “Effect of flutamide or cyproterone acetate on pituitary and testicular hormones in normal men”. The Journal of Clinical Endocrinology and Metabolism. 59 (5): 963–9. doi:10.1210/jcem-59-5-963. PMID 6237116.
- ^ Jacobi GH, Altwein JE, Kurth KH, Basting R, Hohenfellner R (tháng 6 năm 1980). “Treatment of advanced prostatic cancer with parenteral cyproterone acetate: a phase III randomised trial”. British Journal of Urology. 52 (3): 208–15. doi:10.1111/j.1464-410x.1980.tb02961.x. PMID 7000222.
- ^ Sherman AI, Woolf RB (tháng 2 năm 1959). “An endocrine basis for endometrial carcinoma”. American Journal of Obstetrics and Gynecology. 77 (2): 233–42. doi:10.1016/0002-9378(59)90223-6. PMID 13617315.
- ^ Geer EB (ngày 1 tháng 12 năm 2016). The Hypothalamic-Pituitary-Adrenal Axis in Health and Disease: Cushing's Syndrome and Beyond. Springer. tr. 28–. ISBN 978-3-319-45950-9.
- ^ Aschenbrenner DS, Venable SJ (2009). Drug Therapy in Nursing. Lippincott Williams & Wilkins. tr. 674–. ISBN 978-0-7817-6587-9.
- ^ Gerber AN, Masuno K, Diamond MI (tháng 3 năm 2009). “Discovery of selective glucocorticoid receptor modulators by multiplexed reporter screening”. Proceedings of the National Academy of Sciences of the United States of America. 106 (12): 4929–34. Bibcode:2009PNAS..106.4929G. doi:10.1073/pnas.0812308106. PMC 2660744. PMID 19255438.
- ^ a b Bardin CW, Brown T, Isomaa VV, Jänne OA (1983). “Progestins can mimic, inhibit and potentiate the actions of androgens”. Pharmacology & Therapeutics. 23 (3): 443–59. doi:10.1016/0163-7258(83)90023-2. PMID 6371845.
- ^ a b c Caritis SN, Sharma S, Venkataramanan R, Hankins GD, Miodovnik M, Hebert MF, Umans JG, Benedetti T, Mattison D, Zajicek A, Fischer D, Jackson A (tháng 11 năm 2012). “Pharmacology and placental transport of 17-hydroxyprogesterone caproate in singleton gestation”. American Journal of Obstetrics and Gynecology. 207 (5): 398.e1–8. doi:10.1016/j.ajog.2012.08.015. PMC 3586341. PMID 22967833.
- ^ a b Caritis SN, Sharma S, Venkataramanan R, Rouse DJ, Peaceman AM, Sciscione A, Spong CY, Varner MW, Malone FD, Iams JD, Mercer BM, Thorp JM, Sorokin Y, Carpenter M, Lo J, Ramin S, Harper M (tháng 7 năm 2011). “Pharmacokinetics of 17-hydroxyprogesterone caproate in multifetal gestation”. American Journal of Obstetrics and Gynecology. 205 (1): 40.e1–8. doi:10.1016/j.ajog.2011.03.028. PMC 3165062. PMID 21620357.
- ^ Ferin J (tháng 9 năm 1972). “Orally Active Progestational Compounds. Human Studies: Effects on the Utero-Vaginal Tract”. Trong M. Tausk (biên tập). Pharmacology of the Endocrine System and Related Drugs: Progesterone, Progestational Drugs and Antifertility Agents. II. Pergamon Press. tr. 245–273. ISBN 978-0080168128. OCLC 278011135.
- ^ a b c “Hydroxyprogesterone caproate oral - Lipocine - AdisInsight”.
- ^ a b DelConte A, Chidambaram N, Nachaegari S, Patel M, Venkateshwaran S (tháng 1 năm 2015). “770: Pharmacokinetics and tolerability of oral 17-hydroxyprogesterone caproate (HPC) relative to intramuscular (IM) HPC”. American Journal of Obstetrics & Gynecology. 212 (1): S374. doi:10.1016/j.ajog.2014.10.976.
- ^ Boggess KA, Baker JB, Murtha AP, Peaceman AM, Shah DM, Siegfried SL, Birch R (tháng 4 năm 2018). “Pharmacokinetics of Hydroxyprogesterone Caproate and its Primary Metabolites during Pregnancy”. AJP Reports. 8 (2): e106–e112. doi:10.1055/s-0038-1639331. PMC 5951785. PMID 29765789.
- ^ a b https://www.accessdata.fda.gov/drugsatfda_docs/label/2011/021945s000lbl.pdf
- ^ a b Ferin J (tháng 9 năm 1972). “Effects, Duration of Action and Metabolism in Man”. Trong Tausk M (biên tập). Pharmacology of the Endocrine System and Related Drugs: Progesterone, Progestational Drugs and Antifertility Agents. II. Pergamon Press. tr. 13–24. ISBN 978-0080168128. OCLC 278011135.
- ^ Santhosh, C. R. (2006). Pharmacokinetics of 17α-Hydroxy Progesterone Caproate in Cattle, Buffalo, Sheep and Goat (Doctoral dissertation, Karnataka Veterinary, Animal and Fisheries Sciences University, Bidar). http://krishikosh.egranth.ac.in/handle/1/68575
- ^ a b c d e f g Elks J (ngày 14 tháng 11 năm 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. tr. 664–. ISBN 978-1-4757-2085-3.
- ^ Engel J, Kleemann A, Kutscher B, Reichert D (ngày 14 tháng 5 năm 2014). Pharmaceutical Substances, 5th Edition, 2009: Syntheses, Patents and Applications of the most relevant APIs. Thieme. tr. 677–679. ISBN 978-3-13-179275-4.
- ^ William Andrew Publishing (ngày 22 tháng 10 năm 2013). Pharmaceutical Manufacturing Encyclopedia. Elsevier. tr. 1865–1866. ISBN 978-0-8155-1856-3.
- ^ Junkmann, Karl; Langecker, Hedwig; Damrosch, Leonore (1968). “Chemie der Gestagene” [Chemistry of Progestogens]. Die Gestagene [Progestogens]. Springer-Verlag. tr. 1–44. doi:10.1007/978-3-642-99941-3_1. ISBN 978-3-642-99941-3.
3. Hydroxyprogesteron-caproat. C27H4004, Mol.-Gew.: 428,62; chemische Bezeichnung Δ4-Pregnen-17α-ol-3,20-dion-17α-capronat, Trivialnamen: Hydroxyprogesteroncapronat, 17α-Hydroxyprogesteron-17α-capronat. Synthese: [88]. Darstellung: [88]. Eigenschaften: weißes kristallines Pulver (aus Isopropyläther) oder Methanol, F.: 119-122⁰, [α]D: +60⁰ (Chlf.) UV-Absorption: λmax.: 240 mμ, ε = 17000. Dipolmoment: [μ = 2,21 (Benzol). Leicht löslich in Äthanol, Äther, Essigester, Benzol, Chloroform, löslich in: Petroläther, unlöslich in Wasser. Bei 20⁰ lösen 100 ml Sesamöl ca. 4,0 g, Ricinusöl ca. 2,5 g, Ricinusöl: Benzylbenzoat (4: 6) ca. 26,5 g, Benzylbenzoat ca. 36,0 g. [...] Abb. 3. IR-Spektrum [126] und Formel des Hydroxyprogesteron-caproat.
- ^ Junkmann, Karl (1954). “Über protrahiert wirksame Gestagene”. Naunyn-Schmiedebergs Archiv für Experimentelle Pathologie und Pharmakologie. 223 (3). doi:10.1007/BF00246995.
- ^ Wied GL, Davis ME (tháng 7 năm 1958). “Comparative activity of progestational agents on the human endometrium and vaginal epithelium of surgical castrates”. Annals of the New York Academy of Sciences. 71 (5): 599–616. Bibcode:1958NYASA..71..599W. doi:10.1111/j.1749-6632.1958.tb46791.x. PMID 13583817.
In the group of new parenteral progestational agents, three substances developed by Karl Junkmann1,2 are the most outstanding and interesting: 17a-hydroxyprogesterone caproate and 17a-hydroxyprogesterone acetate, introduced in 1953, and the most potent of all new parenteral progestational agents, 17-ethynyl-19-nortestosterone enanthate, introduced in 1956.
- ^ ACRH. U.S. Dept. of Energy. 1960. tr. 71.
[The] minimal activity [of 17(a)-hydroxyprogesterone] is magnified to an unexpected degree by the esterification of this steroid with caproic acid to produce 17(a)-hydroxyprogesterone-17-n-caproate, first reported by Karl Junkmann in 1954.6,7
- ^ Dorfman RI (1966). Methods in Hormone Research. Academic Press. tr. 86.
Junkmann (1954) reported that the acetate, butyrate, and caproate forms had both increased and prolonged activity, [...]
- ^ Applezweig N (1962). Steroid Drugs. Blakiston Division, McGraw-Hill. tr. 101–102.
Junkmann of Schering, AG., however, was able to show that long chain esters of 17a-hydroxyprogesterones such as the 17a-caproate produced powerful long-acting progestational effect. This compound is marketed in the United States as Delalutin by Squibb, and has been heavily used for the treatment of habitual abortion.
- ^ New and Nonofficial Drugs. Lippincott. 1958. tr. 662.
Supplied by.—E. R. Squibb & Sons (Delalutin). Year of introduction: 1956.
- ^ Tausk M (1975). Pharmacology of hormones. Thieme. tr. 105. ISBN 978-3-13-518901-7.
Progesterone itself is now almost never used for the management of any imminent threat to pregnancy. For oral therapy, it is in any event unsuitable and for injections, it has now been replaced by the long-acting esters of 17α-hydroxyprogesterone. The caproate (Proluton, Delalutin), a long-acting ester, is available in [...] Progesterone is rarely used therapeutically. It has largely been superseded by a long-acting ester of 17α-hydroxyprogesterone, for parenteral therapy.
- ^ FDA press release regarding Makena approval
- ^ O'Brien JM (tháng 9 năm 2013). “Medication safety is still an issue in obstetrics 50 years after the Kefauver-Harris amendments: the case of progestogens”. Ultrasound in Obstetrics & Gynecology. 42 (3): 247–53. doi:10.1002/uog.12456. PMID 23495199.
- ^ a b c Sweetman, Sean C. biên tập (2009). “Sex hormones and their modulators”. Martindale: The Complete Drug Reference (ấn bản 36). London: Pharmaceutical Press. tr. 2110–2111. ISBN 978-0-85369-840-1.
- ^ “Price of preterm birth medicine cut”. Boston.com. Associated Press. ngày 2 tháng 4 năm 2011. Truy cập ngày 2 tháng 4 năm 2011.
- ^ Goldsmith A, Toppozada M (1983). “Long-acting contraception”. Symposium on Long-Acting Contraception (Alexandria, Egypt). Chicago, Illinois: Northwestern University, Program for Applied Research on Fertility Regulation. tr. 94–95. Bản gốc lưu trữ ngày 24 tháng 3 năm 2019. Truy cập ngày 30 tháng 6 năm 2019.
- ^ Toppozada M (tháng 6 năm 1977). “The clinical use of monthly injectable contraceptive preparations”. Obstetrical & Gynecological Survey. 32 (6): 335–47. doi:10.1097/00006254-197706000-00001. PMID 865726.
- ^ Dao, Thomas L. (1975). “Pharmacology and Clinical Utility of Hormones in Hormone Related Neoplasms”. Trong Alan C. Sartorelli; David G. Johns (biên tập). Antineoplastic and Immunosuppressive Agents. tr. 170–192. doi:10.1007/978-3-642-65806-8_11. ISBN 978-3-642-65806-8.
- ^ Crowley, Lawrence G.; Macdonald, Ian (1962). “Clinical trial of Delalutin in the treatment of advanced mammary carcinoma in postmenopausal women”. Cancer. 15 (6): 1218–1220. doi:10.1002/1097-0142(196211/12)15:6<1218::AID-CNCR2820150619>3.0.CO;2-Y. ISSN 0008-543X. PMID 14024037.
- ^ Geller J, Volk H, Lewin M (tháng 10 năm 1961). “Objective remission of metastatic breast carcinoma in a male who received 17-alpha hydroxy progesterone caproate (Delalutin)”. Cancer Chemotherapy Reports. 14: 77–81. ISSN 0069-0112. PMID 13897631.
- ^ Crowley, Lawrence G.; Macdonald, Ian (1965). “Delalutin and estrogens for the treatment of advanced mammary carcinoma in the postmenopausal woman”. Cancer. 18 (4): 436–446. doi:10.1002/1097-0142(196504)18:4<436::AID-CNCR2820180407>3.0.CO;2-D. ISSN 0008-543X. PMID 14278040.
- ^ Crowley, L.G.; MacDonald, J. (1966). “Delalutin und Östrogene als Behandlung des vorgeschrittenen Mammakarzinoms bei Frauen nach der Menopause” [Delalutin and estrogens as a treatment for advanced breast cancer in postmenopausal women]. Gynäkologisch-geburtshilfliche Rundschau. 3 (4): 271–272. doi:10.1159/000266855. ISSN 1018-8843.
- ^ Firusian N, Schietzel M (tháng 9 năm 1976). “Zur additiven Therapie des metastasierenden Mamma-Karzinoms unter Berücksichtigung des Postmenopausalaltes (Ergebnisse einer randomisierten Studie)” [Additive treatment of metastasizing breast cancer with special reference to postmenopausal age (results of a randomized study)]. Strahlentherapie (bằng tiếng Đức). 152 (3): 235–47. ISSN 0039-2073. PMID 968923.
Đọc thêm sửa
- Meis PJ (tháng 5 năm 2005). “17 hydroxyprogesterone for the prevention of preterm delivery”. Obstetrics and Gynecology. 105 (5 Pt 1): 1128–35. doi:10.1097/01.AOG.0000160432.95395.8f. PMID 15863556.
- Facchinetti F, Vaccaro V (tháng 10 năm 2009). “Pharmacological use of progesterone and 17-alpha-hydroxyprogesterone caproate in the prevention of preterm delivery”. Minerva Ginecologica. 61 (5): 401–9. PMID 19749671.
- Deeks ED (tháng 10 năm 2011). “17 α-Hydroxyprogesterone caproate (Makena™): in the prevention of preterm birth”. Paediatric Drugs. 13 (5): 337–45. doi:10.2165/11208140-000000000-00000. PMID 21888448.
- Merlob P, Stahl B, Klinger G (tháng 1 năm 2012). “17α Hydroxyprogesterone caproate for prevention of recurrent spontaneous preterm birth”. Reproductive Toxicology. 33 (1): 15–9. doi:10.1016/j.reprotox.2011.10.017. PMID 22120850.
- O'Brien JM (tháng 10 năm 2012). “The safety of progesterone and 17-hydroxyprogesterone caproate administration for the prevention of preterm birth: an evidence-based assessment”. American Journal of Perinatology. 29 (9): 665–72. doi:10.1055/s-0032-1316444. PMID 22773279.
- Romero R, Stanczyk FZ (tháng 6 năm 2013). “Progesterone is not the same as 17α-hydroxyprogesterone caproate: implications for obstetrical practice”. American Journal of Obstetrics and Gynecology. 208 (6): 421–6. doi:10.1016/j.ajog.2013.04.027. PMC 4120746. PMID 23643669.
- Feghali M, Venkataramanan R, Caritis S (tháng 12 năm 2014). “Prevention of preterm delivery with 17-hydroxyprogesterone caproate: pharmacologic considerations”. Seminars in Perinatology. 38 (8): 516–22. doi:10.1053/j.semperi.2014.08.013. PMC 4253874. PMID 25256193.
- Saccone G, Suhag A, Berghella V (tháng 7 năm 2015). “17-alpha-hydroxyprogesterone caproate for maintenance tocolysis: a systematic review and metaanalysis of randomized trials”. American Journal of Obstetrics and Gynecology. 213 (1): 16–22. doi:10.1016/j.ajog.2015.01.054. PMID 25659469.
- O'Brien JM, Lewis DF (tháng 1 năm 2016). “Prevention of preterm birth with vaginal progesterone or 17-alpha-hydroxyprogesterone caproate: a critical examination of efficacy and safety”. American Journal of Obstetrics and Gynecology. 214 (1): 45–56. doi:10.1016/j.ajog.2015.10.934. PMID 26558340.
- Caritis SN, Feghali MN, Grobman WA, Rouse DJ (tháng 8 năm 2016). “What we have learned about the role of 17-alpha-hydroxyprogesterone caproate in the prevention of preterm birth”. Seminars in Perinatology. 40 (5): 273–80. doi:10.1053/j.semperi.2016.03.002. PMC 4983195. PMID 27105940.
- Saccone G, Khalifeh A, Elimian A, Bahrami E, Chaman-Ara K, Bahrami MA, Berghella V (tháng 3 năm 2017). “Vaginal progesterone vs intramuscular 17α-hydroxyprogesterone caproate for prevention of recurrent spontaneous preterm birth in singleton gestations: systematic review and meta-analysis of randomized controlled trials”. Ultrasound in Obstetrics & Gynecology. 49 (3): 315–321. doi:10.1002/uog.17245. PMID 27546354.
- Oler E, Eke AC, Hesson A (tháng 7 năm 2017). “Meta-analysis of randomized controlled trials comparing 17α-hydroxyprogesterone caproate and vaginal progesterone for the prevention of recurrent spontaneous preterm delivery”. International Journal of Gynaecology and Obstetrics. 138 (1): 12–16. doi:10.1002/ijgo.12166. PMID 28369874.
- Manuck TA (tháng 12 năm 2017). “17-alpha hydroxyprogesterone caproate for preterm birth prevention: Where have we been, how did we get here, and where are we going?”. Seminars in Perinatology. 41 (8): 461–467. doi:10.1053/j.semperi.2017.08.004. PMID 28947068.