Lục lạp
Lục lạp (tiếng Anh: chloroplast, phát âm tiếng Anh: /ˈklɔːrəˌplæst,


Vai trò chính của lục lạp là thực hiện chức năng quang hợp, đây là nơi chứa các chất diệp lục có khả năng hấp thụ năng lượng từ ánh sáng mặt trời, chuyển hóa và lưu giữ năng lượng đó trong các phân tử cao năng là ATP và NADPH, đồng thời giải phóng khí oxy từ nước. Sau đó, lục lạp sử dụng năng lượng từ ATP và NADPH để tạo nên các phân tử hữu cơ từ carbon dioxide (CO2) theo một quá trình gọi là chu trình Calvin. Ngoài ra, lục lạp còn thực hiện một số chức năng khác, gồm có tổng hợp acid béo, nhiều loại amino acid, và các phản ứng miễn dịch ở thực vật. Số lượng lục lạp trong mỗi tế bào thay đổi đa dạng từ một trong tảo đơn bào đến tận 100 trong thực vật, ví dụ như cải Arabidopsis và lúa mì.[3]
Lục lạp thuộc một nhóm bào quan rộng hơn gọi là lạp thể (plastid), đặc trưng bởi nồng độ chất diệp lục cao, những lạp thể khác, như vô sắc lạp (leucoplast) và sắc lạp (chromoplast) chứa ít diệp lục và không thực hiện chức năng quang hợp.
Lục lạp cực kì linh động—nó dễ dàng di chuyển và lưu thông khắp tế bào thực vật, thỉnh thoảng tự thắt lại để tiến hành quá trình phân đôi. Hoạt động của nó chịu ảnh hưởng mạnh từ các nhân tố môi trường như màu sắc và cường độ ánh sáng. Lục lạp, giống như ty thể, có chứa DNA riêng, được cho là kế thừa từ tổ tiên—một loài vi khuẩn lam có khả năng quang hợp mà sau đó nội cộng sinh với tế bào nhân thực sơ khai. Lục lạp không tạo ra bởi tế bào thực vật mà chỉ sinh ra từ lục lạp trước đó song hành với quá trình phân bào.
Với một ngoại lệ (trùng amip Paulinella chromatophora), tất cả lục lạp đều có thể đã phát sinh từ một quá trình nội cộng sinh duy nhất (nội cộng sinh sơ cấp): khi một loài vi khuẩn lam hòa hợp với tế bào nhân thực. Mặc dù vậy, lục lạp vẫn có thể tìm thấy trong một bộ phận rộng lớn nhiều loài sinh vật, thậm chí một số trường hợp còn không có nguồn gốc lục lạp liên quan đến nhau, đây là một hệ quả của những quá trình nội cộng sinh lần thứ hai và thứ ba (nội cộng sinh thứ cấp).
Thuật ngữ chloroplast (tiếng Hy Lạp: χλωροπλάστης) bắt nguồn từ chữ Hy Lạp chloros (χλωρός), nghĩa là màu xanh, và plastes (πλάστης), nghĩa là "sản xuất, hình thành".[4]
Khám phá sửa
Năm 1837, Hugo von Mohl là người đầu tiên đưa ra những mô tả đầy đủ về lục lạp (tiếng Đức: Chlorophyllkörnen, "hạt chứa chlorophyll (diệp lục)") như những thể đứt đoạn trong tế bào xanh của thực vật.[5] Năm 1883, A. F. W. Schimper gọi tên những thể này là "chloroplastid" (tiếng Đức: Chloroplastiden).[6] Năm 1884, Eduard Strasburger thông qua thuật ngữ "chloroplast" (lục lạp, tiếng Đức: Chloroplasten).[7][8][9]
Những dòng lục lạp và sự tiến hóa sửa
Lục lạp là một trong nhiều loại bào quan khác nhau trong tế bào thực vật. Nó được cho là có nguồn gốc từ vi khuẩn lam thông qua quá trình nội cộng sinh—khi một tế bào nhân thực hòa hợp một loài vi khuẩn lam có khả năng quang hợp thường trú lâu dài trong tế bào. Ty thể là bào quan cũng có nguồn gốc tương tự lục lạp, chỉ khác đó là vi khuẩn hiếu khí nội cộng sinh thay vì vi khuẩn lam quang hợp.[10] Giả thuyết về nguồn gốc này của lục lạp lần đầu tiên đề xuất bởi nhà sinh vật học người Nga Konstantin Mereschkowski vào năm 1905[11] sau khi Andreas Schimper quan sát năm 1883 chỉ ra rằng lục lạp có vẻ gần giống vi khuẩn lam.[12] Trong sinh giới, lục lạp chỉ được tìm thấy trong thực vật và tảo.[13]
Tổ tiên là vi khuẩn lam sửa
Vi khuẩn lam được cho là tổ tiên của lục lạp. Đôi khi nó được gọi là tảo lục lam mặc dù vi khuẩn lam là sinh vật nhân sơ (còn tảo là sinh vật nhân thực, và tảo lục lam thực chất là tên gọi ngành tảo Glaucophyta). Vi khuẩn lam là một ngành đa dạng của nhóm vi khuẩn có khả năng quang hợp, và thuộc loại vi khuẩn Gram âm, do đó có chứa hai lớp màng tế bào. Vi khuẩn lam cũng có một lớp thành tế bào peptidoglycan, dày hơn so với các vi khuẩn Gram âm khác, nằm giữa hai lớp màng.[14] Giống như lục lạp, nó cũng có cấu trúc thylakoid bên trong.[15] Trên màng thylakoid có các sắc tố quang hợp, bao gồm chất diệp lục a (chlorophyll a).[16] Phycobilin cũng là một loại sắc tố phổ biến khác của vi khuẩn lam, thường tích hợp vào thể phycobilisome đính ở phía ngoài lớp màng thylakoid (tuy vậy không phải lục lạp nào cũng có sắc tố phycobilin kế thừa từ vi khuẩn lam).[16][17]
Quá trình nội cộng sinh lần thứ nhất sửa
Một tế bào nhân thực chứa ty thể hòa hợp một vi khuẩn lam trong một chuỗi quá trình nội cộng sinh nối tiếp nhau, tạo nên một dòng tế bào chứa cả hai bào quan này.[10] Điều quan trọng cần lưu ý là các vi khuẩn lam nội cộng sinh thực sự đã có lớp màng kép ngay từ đầu—còn lớp màng thực bào (phagosomal membrane) bao quanh đã tiêu biến.[18]
Một tế bào nhân thực chứa ty thể hòa hợp một vi khuẩn lam trong một chuỗi quá trình nội cộng sinh nối tiếp nhau, tạo nên một dòng tế bào chứa cả hai bào quan này.[10] Điều quan trọng cần lưu ý là các vi khuẩn lam nội cộng sinh thực sự đã có lớp màng kép ngay từ đầu—còn lớp màng thực bào (phagosomal membrane) bao quanh đã tiêu biến.[18]
Ở một nơi nào đó trên Trái Đất khoảng 1 tỷ năm trước,[19] một con vi khuẩn lam sống tự do đã chui vào một tế bào nhân thực sơ khai, hoặc như là thức ăn của tế bào nhân thực hoặc như là một ký sinh trùng,[10] nó được chứa trong một không bào thực bào.[16] Hai màng lipid kép[20] của tất cả các loại lục lạp hiện nay đều có nguồn gốc từ màng ngoài và màng trong trong cấu trúc thành tế bào của tổ tiên là vi khuẩn lam Gram âm,[18][21][22] và hẳn là không phải lấy từ màng thực bào của tế bào nhân thực chủ, lớp màng đó có lẽ đã tiêu biến.[18] Tế bào nhân thực có vẻ hưởng nhiều lợi ích khi cho phép những thực thể mới là vi khuẩn lam sống trong mình, thực hiện quá trình quang hợp đồng hóa và cung cấp thức ăn cho tế bào chủ.[10] Dần dần theo thời gian, vi khuẩn lam bị hòa hợp, nhiều gen của nó đã mất đi hoặc chuyển vào bộ gen trong nhân tế bào chủ.[23] Một số protein của nó sau này tổng hợp trong tế bào chất của tế bào chủ, và nhập trở lại vào lục lạp (trước đây từng là vi khuẩn lam).[23][24]
Quá trình này được gọi là nội cộng sinh (endosymbiosis), nôm na là "tế bào này sống trong tế bào khác". Các tế bào sống bên trong các tế bào khác được gọi là tế bào nội cộng sinh (endosymbiont); còn các tế bào nội cộng sinh lại cư trú bên trong các tế bào chủ (host cell) chứa mình.[10]
Lục lạp được cho là xuất hiện sau ty thể, nguyên nhân là do tất cả tế bào nhân thực đều có chứa ty thể, nhưng không phải tế bào nào cũng có lục lạp.[10][25] Đây là hệ quả của một hiện tượng gọi là chuỗi quá trình nội cộng sinh nối tiếp nhau, nghĩa là một tế bào nhân thực sơ khai đã hòa hợp được tổ tiên ty thể, và một số hậu duệ của nó sau đó đã hòa hợp nốt tổ tiên lục lạp, tạo nên một dòng tế bào có cả lục lạp và ty thể.[10]
Có hay không có những lục lạp đến từ một quá trình nội cộng sinh duy nhất, hay từ nhiều quá trình tương tự diễn ra trên khắp các dòng tế bào nhân thực khác nhau? Điều này đã gây tranh cãi một thời gian dài, nhưng bây giờ các nhà khoa học nhất trí rằng: tất cả các sinh vật chứa lục lạp hoặc đã phát sinh từ một tổ tiên duy nhất hoặc có được lục lạp từ các sinh vật có chung tổ tiên là một tế bào nhân thực đã hòa hợp hóa một con vi khuẩn lam sống khoảng 600–1.600 triệu năm về trước.[19]
Có những loại lục lạp, mà nó trực tiếp phát sinh từ tổ tiên là vi khuẩn lam, được biết đến với cái tên lạp thể sơ cấp[26] (primary plastid), lưu ý là "lạp thể" trong ngữ cảnh bài này có nghĩa là một thực thể gần như tương tự lục lạp.[10] Tất cả lục lạp sơ cấp đều thuộc một trong ba dòng sau đây: dòng lục lạp tảo lục lam (glaucophyte), dòng lục lạp tảo đỏ (rhodophyte) và dòng lục lạp xanh lục (chloroplastidan).[27] Trong đó, dòng thứ hai là lớn nhất, còn dòng lục lạp xanh lục thì có ở thực vật đất liền và tảo lục.[18]
| Glaucophyta (Tảo lục lam) |
Dòng lục lạp Quá trình nội cộng sinh lần thứ nhất phát sinh nên ba dòng lục lạp chính trong Glaucophyta (tảo lục lam), Chlorophyta (một ngành tảo lục) và Rhodophyta (tảo đỏ).[27] Một số loại tảo sau đó đã hòa hợp vào các loại tảo khác, trở thành những tế bào nội cộng sinh lần thứ hai (hoặc lần thứ ba).[16][18] a Các cá thể apicomplexa (ký sinh trùng sốt rét) chứa một tế bào tảo đỏ nội cộng sinh có loại lục lạp không thể quang hợp.[28] b Lục lạp màng 2–3 lớp[16] a c Lục lạp màng 2–4 lớp[16] | ||||||
| Chloroplastida | Euglenophyta | ||||||
| Chlorarachniophyta | |||||||
| Dinophyta tảo lục | |||||||
| Rhodophyceae (Tảo đỏ) |
Apicomplexa a | ||||||
| Dinophyta b chứa peridinin | |||||||
| Cryptophyta | |||||||
| Haptophyta | Dinophyta haptophyte c | ||||||
| Heterokontophyta | Dinophyta tảo cát | ||||||
| Nội cộng sinh lần thứ nhất | Nội cộng sinh lần thứ hai | Nội cộng sinh lần thứ ba | |||||
Glaucophyta (tảo lục lam) sửa
Xem thêm: Vi khuẩn lam
Loài tảo Cyanophora, một loại tảo glaucophyte (chữ này là số ít tiếng Anh của danh pháp: Glaucophyta, tiếng Việt: tảo lục lam), được cho là một trong những sinh vật đầu tiên có lục lạp.[24] Dòng lục lạp tảo lục lam có quy mô nhỏ nhất trong ba dòng lục lạp sơ cấp, chỉ mới tìm thấy trong 13 loài,[18] và được xem là dòng lục lạp xuất hiện sớm nhất.[18][19][29] Tảo lục lam chứa loại lục lạp có một thành peptidoglycan nằm giữa hai lớp màng lipid kép,[26] giống như tổ tiên của nó là vi khuẩn lam.[14] Vì vậy, lục lạp tảo lục lam còn có tên là muroplast[26] (tiền tố muro- có nguồn gốc từ tiếng Latin "mura"–nghĩa là "thành, tường"). Loại lục lạp này cũng chứa cấu trúc thylakoid đồng tâm nhưng không xếp thành chồng, các lớp thylakoid bao quanh lấy một thể carboxysome – một cấu trúc dạng khối hai mươi mặt đều, nơi lục lạp tảo lục lam lưu trữ enzyme rubisco cố định carbon trong đó. Lượng tinh bột mà lục lạp tổng hợp sẽ gom lại tống ra bên ngoài nó.[16] Tương tự vi khuẩn lam, thylakoid của lục lạp tảo lục lam cũng được khảm với một cấu trúc hấp thụ ánh sáng gọi là thể phycobilisome.[16][26] Với những đặc điểm trên, lục lạp tảo lục lam được xem là một dạng trung gian nguyên thủy giữa vi khuẩn lam và những loại lục lạp tiến hóa hơn trong tảo đỏ và thực vật.[26]
Rhodophyceae (tảo đỏ) sửa
Lục lạp tảo rhodophyte (chú thích: rhodophyte là số ít tiếng Anh của danh pháp Rhodophyta—ngành Tảo đỏ; còn Rhodophyceae ở tiêu đề là tên lớp đồng nghĩa với ngành) hay lục lạp tảo đỏ là dòng lục lạp rộng lớn và phong phú.[18] Lục lạp tảo đỏ (rhodophyte chloroplast) còn được gọi là rhodoplast,[26] nghĩa đen là "lục lạp đỏ".[31]
Lục lạp tảo đỏ có lớp màng kép, không gian xen giữa hai lớp màng gọi là xoang gian màng và có các sắc tố phycobilin lưu trữ bên trong các thể phycobilisome nằm trên màng thylakoid, ở loại lục lạp này các cấu trúc thylakoid vẫn chưa thể xếp thành chồng.[16] Một số trường hợp có chứa pyrenoid[26]—một cấu trúc protein siêu vi có trong lục lạp của tảo và rêu sừng, nó liên quan đến quá trình cố định carbon và tổng hợp, lưu trữ tinh bột. Lục lạp tảo đỏ có hai loại sắc tố quang hợp là diệp lục a (chlorophyll a) và phycobilin;[29] một phân nhóm của sắc tố phycobilin là phycoerytherin chính là nguyên nhân quan trọng khiến cho nhiều loài tảo đỏ có màu đỏ đặc trưng[30] (do phycoerytherin hấp thu kém ánh sáng đỏ nên đa phần phản xạ lại loại ánh sáng này). Tuy nhiên, kể từ khi lục lạp tảo đỏ chứa thêm diệp lục a và các sắc tố khác, nhiều loại màu mới từ đỏ đến tím đã xuất hiện.[26] Các sắc tố đỏ phycoerytherin là một sự thích nghi để giúp tảo đỏ có thể hấp thụ nhiều ánh sáng hơn trong môi trường nước sâu[26]—như vậy, một vài loại tảo đỏ khác sống ở vùng nước nông sẽ có ít sắc tố phycoerytherin hơn trong lục lạp của chúng, và trở nên "xanh" hơn.[30] Lục lạp tảo đỏ có thể tổng hợp nên một dạng tinh bột gọi là tinh bột floridean[26] (loại tinh bột cấu tạo từ các polymer "bán amylopectin"), nó được gom lại thành các hạt nhỏ ở ngoài lục lạp, nằm trong tế bào chất của tế bào tảo đỏ.[16]
Chloroplastida (tảo lục và thực vật) sửa
Lục lạp chloroplastidan (số ít tiếng Anh của danh pháp: Chloroplastida, là tên gọi khác của nhóm sinh vật Viridiplantae), hay còn gọi là "lục lạp xanh lục", là dòng lục lạp sơ cấp quy mô lớn và rất phong phú, đa dạng. Sinh vật chủ yếu chứa loại lục lạp này là tảo lục và thực vật đất liền.[32] Lục lạp xanh lục khác biệt so với lục lạp tảo lục lam và lục lạp tảo đỏ ở việc mất đi thể phycobilisome, và thay vào đó là sắc tố diệp lục b (chlorophyll b). Hầu hết lục lạp xanh lục "thực sự" có màu xanh, mặc dù một vài trường hợp thì không, giống như một số dạng lục lạp của loài tảo Haematococcus pluvialis, nguyên nhân là do có các sắc tố phụ chèn lên màu xanh diệp lục. Lục lạp xanh lục mất đi thành peptidoglycan nằm giữa hai lớp màng, và thay thế nó bằng một không gian gọi là xoang gian màng.[16] Một số loài thực vật dường như đã giữ lại các gen dùng để tổng hợp lớp peptidoglycan này, mặc dù mục đích sử dụng lại khác đi, không dùng để cấu tạo nên thành nữa mà tham gia vào quá trình phân đôi lục lạp (hình thành các đai thắt chia đôi khối nguyên sinh chất).[33]
Phần lớn lục lạp miêu tả trong bài viết này đều là lục lạp xanh lục.
Tảo lục và thực vật giữ lại tinh bột bên trong lục lạp (thay vì tống ra ngoài tế bào chất),[16][29][32] và ở thực vật và một vài loài tảo, thylakoid của lục lạp xếp lại thành các chồng, chồng đó gọi là grana. Một số lục lạp tảo lục có chứa cấu trúc pyrenoid,[16] có chức năng tương tự như thể carboxysome ở tảo lục lam, là nơi enzyme rubisco và CO2 tập trung trong lục lạp.[34]
Helicosporidium sửa
Helicosporidium là một chi tảo lục ký sinh không quang hợp, nó được cho là có chứa những tàn tích của lục lạp.[29] Phân tích gen từ một lục lạp[35] và các gen của nhân tế bào cho thấy lục lạp từng tồn tại trong chi Helicosporidium, dù chẳng ai có thể nhìn thấy được lục lạp của chúng.[29]
Quá trình nội cộng sinh lần thứ hai và thứ ba sửa
Rất nhiều sinh vật khác nhau có lục lạp từ các dòng lục lạp sơ cấp thông qua quá trình nội cộng sinh lần thứ hai—tức là tiến hành hòa hợp một tế bào tảo đỏ hay tảo lục có chứa lục lạp. Những lục lạp như thế này được gọi là các lạp thể cấp hai (secondary plastid).[26]
Trong khi lục lạp sơ cấp có lớp màng kép từ tổ tiên vi khuẩn lam của nó, thì lục lạp cấp hai lại có thêm những lớp màng mới bên ngoài màng kép này, đó là kết quả của quá trình nội cộng sinh lần thứ hai, khi một tế bào nhân thực không có khả năng quang hợp hòa hợp một tế bào tảo chứa lục lạp nhưng không tiêu hóa nó—có vẻ giống như trường hợp nội cộng sinh vi khuẩn lam ở giai đoạn sơ khai trước đó.[18] Các tế bào tảo nội cộng sinh sẽ bị tiêu hủy, chỉ để lại duy nhất lục lạp của nó, và thỉnh thoảng còn có thêm màng tế bào và nhân, tạo nên loại lục lạp màng 3 hoặc 4 lớp[36]—gồm hai màng của tổ tiên vi khuẩn lam, có thể có thêm màng tế bào tảo bị nuốt, và màng thực bào nguồn gốc từ màng tế bào chủ.[18]
Những gen trong nhân tế bào nhân thực bị thực bào thường chuyển cho nhân tế bào chủ.[18] Còn hai ngành tảo Cryptophyta và Chlorarachniophyta vẫn giữ lại nhân, chuyển hóa thành tàn tích là một cấu trúc gọi là nucleomorph,[18] nằm giữa lớp màng thứ hai và thứ ba của lục lạp.[16][24]
Tất cả các lục lạp cấp hai đều xuất phát từ tảo lục và tảo đỏ, còn từ tảo lục lam thì không quan sát thấy, có lẽ là vì tảo lục lam tương đối hiếm trong tự nhiên, khiến cho chúng ít có khả năng bị hòa hợp bởi các tế bào nhân thực khác.[18]
Lục lạp nguồn gốc tảo lục sửa
Tảo lục từng bị bắt giữ, nuốt chửng và hòa hợp vào trùng roi Euglenid, tảo Chlorarachniophyta,[29] một dòng của ngành tảo Dinoflagellata và có thể có cả tổ tiên của siêu nhóm nhân thực Chromalveolata[37] trong ba hoặc bốn lần thực bào riêng biệt.[38] Nhiều lục lạp nguồn gốc tảo lục có chứa pyrenoid, và không giống như lục lạp tảo lục, tinh bột ở đây đóng gói thành các hạt nằm ngoài lục lạp thay vì nằm trong.[16]
Euglenophyta sửa
Euglenophyta (số ít tiếng Anh: euglenophyte) là một ngành gồm các sinh vật nguyên sinh có roi, trong đó có hai lớp chính là Euglenid và Kinetoplastida, chúng chứa loại lục lạp nguồn gốc tảo lục.[18] Lục lạp của euglenophyte có 3 màng—điều đó cho thấy lớp màng của tế bào nội cộng sinh đã mất đi, chỉ còn lại hai màng ban đầu của vi khuẩn lam và màng thực bào nguồn gốc từ màng tế bào chủ.[18] Lục lạp euglenophyte có một pyrenoid và ba chồng thylakoid. Tinh bột được lưu trữ dưới dạng paramylon (một loại carbohydrate tương tự tinh bột thực sự), chứa trong các hạt có màng bao trôi nổi khắp tế bào chất tế bào.[16][29]
Chlorarachniophyta sửa
Chlorarachniophyta (số ít tiếng Anh: chlorarachniophyte) là một nhóm sinh vật hiếm hoi chứa các lục lạp nguồn gốc tảo lục,[18] mặc dù tiến trình hình thành của chúng phức tạp hơn so với các loại tảo Euglenophyta. Tổ tiên của Chlorarachniophyta được cho một loài trong siêu nhóm Chromalveolata, đó là một tế bào nhân thực có loại lục lạp nguồn gốc tảo đỏ. Sau đó, lục lạp nguồn gốc tảo đỏ mất đi, và cuối cùng chlorarachniophyte lại nuốt chửng và hòa hợp một tế bào tảo lục, cung cấp cho nó loại lục lạp thứ hai, đó chính là lục lạp nguồn gốc tảo lục.[29]
Lục lạp chlorarachniophyte bao bọc bởi 4 lớp màng, ngoại trừ trường hợp khi nằm gần màng tế bào, các màng của lục lạp sẽ gộp lại thành lớp màng kép duy nhất.[16] Thylakoid của nó sắp xếp thành ba chồng grana lỏng lẻo.[16] Chlorarachniophyta lưu trữ tinh bột trong tế bào chất dưới dạng chrysolaminarin[29] (một loại polymer sinh học phổ biến nhất sinh giới cùng với cellulose), thường đóng gói và tập trung xung quanh pyrenoid của lục lạp, phình thành khối lấn ra tế bào chất.[16]
Điểm đáng chú ý ở lục lạp chlorarachniophyte là tế bào tảo lục phát sinh nên loại lục lạp này không hòa hợp một cách hoàn toàn—nhân tế bào tảo lục đó vẫn còn tồn tại dưới dạng tàn tích là cấu trúc nucleomorph[18] tìm thấy giữa màng lục lạp thứ 2 và thứ 3[16]—không gian giữa hai màng này được gọi là xoang periplastid (peri-: kề ngoài cùng, còn xoang ngoài cùng tạo ra từ màng lục lạp thứ 3 và thứ 4), đây là phần còn sót lại của khối nguyên sinh chất của tế bào tảo lục ban đầu.[29]
Chromalveolata sơ khai sửa
Nghiên cứu gần đây cho thấy tổ tiên sơ khai của Chromalveolata (số ít tiếng Anh: chromalveolate; một siêu nhóm ngang giới sinh vật nguyên sinh) đã hòa hợp lấy tế bào tảo prasinophyte (một lớp Tảo lục đơn bào) nội cộng sinh. Các lục lạp nguồn gốc tảo lục sau này đã mất đi và thay thế bằng loại nguồn gốc tảo đỏ, nhưng sự thay thế đó chỉ diễn ra sau khi lục lạp nguồn gốc tảo lục chuyển xong các gen của nó vào nhân tế bào chromalveolate sơ khai. Sự hiện diện của cả hai loại gen tảo lục và tảo đỏ trong Chromalveolata giúp cho chúng phát triển tốt hơn dưới điều kiện ánh sáng thất thường, thiếu thốn.[37]
Lục lạp nguồn gốc tảo đỏ (lục lạp chromalveolate) sửa
Tương tự như tảo lục, tảo đỏ cũng từng bị bắt giữ và nuốt chửng trong quá trình nội cộng sinh lần thứ hai, dường như người ta cho rằng tất cả lục lạp nguồn gốc tảo đỏ phát sinh từ một tế bào tảo đỏ duy nhất bị hòa hợp bởi một tế bào chromalveolate sơ khai, hình thành nên các hậu duệ chromalveolate sau này, ví dụ như trùng lông, nhưng ngành này đã tự tiêu biến đi lục lạp của chúng.[18][29][30] Đây là một hiện tượng vẫn còn trong vòng tranh cãi.[29][30]
Pyrenoid và cấu trúc thylakoid xếp chồng có nhiều trong lục lạp chromalveolate, nó có lớp màng ngoài cùng liên kết trực tiếp với mạng lưới nội chất hạt và khảm trên đó li ti các ribosome.[16][29] Loại lục lạp này mất đi các thể phycobilisome và thay vào đó là sắc tố diệp lục c (chlorophyll c), nhưng lạ thay loại sắc tố này lại không thể tìm thấy trong chính lục lạp của tảo đỏ—tổ tiên phát sinh nên lục lạp nguồn gốc tảo đỏ (lục lạp chromalveolate).[16]
Cryptophyta sửa
Cryptophyta (số ít tiếng Anh: cryptophyte) là một nhóm tảo có loại lục lạp nguồn gốc tảo đỏ. Lục lạp cryptophyte chứa một nucleomorph, nhìn thoáng qua khá giống loại lục lạp chlorarachniophyte.[18] Lục lạp cryptophyte có 4 lớp màng, trong đó màng ngoài cùng liên kết trực tiếp với mạng lưới nội chất hạt. Chúng tổng hợp tinh bột dạng thường, được gom lại lưu trữ trong các hạt ở xoang periplastid—khoảng không gian phía ngoài lớp màng kép trong cùng, là phần còn sót lại của nguyên sinh chất tế bào tảo đỏ—tổ tiên của nó. Bên trong lục lạp cryptophyte có một pyrenoid và hai chồng thylakoid.[16]
Loại lục lạp này không chứa thể phycobilisome,[16] nhưng nó lại có sắc tố phycobilin lưu trữ rải rác trong xoang thylakoid, thay vì đính ở phía ngoài màng thylakoid.[16][18]
Haptophyta sửa
Haptophyta (số ít tiếng Anh: haptophyte) là ngành tảo tương tự và liên quan khắng khít với ngành Cryptophyta, đây được cho là phân nhánh đầu tiên của siêu nhóm Chromalveolata.[29] Lục lạp của chúng sót mất nucleomorph,[16][18] còn các thylakoid thì xếp thành 3 chồng, và chúng có thể tổng hợp loại tinh bột chrysolaminarin—lưu trữ hoàn toàn bên ngoài lục lạp, trong tế bào chất của haptophyte.[16]
Heterokontophyta (Stramenopiles) sửa
Heterokontophyta (số ít tiếng Anh: heterokontophyte), còn gọi là Stramenopiles, là một liên ngành tảo rất lớn và đa dạng chứa lục lạp nguồn gốc tảo đỏ.[29] Nhóm tảo heterokont (số ít tiếng Anh của danh pháp: Heterokonta, một từ đồng nghĩa với Heterokontophyta và Stramenopiles ở đầu đoạn) bao gồm các lớp: Tảo cát, Tảo nâu, Tảo vàng[30] và Tảo vàng xanh.
Lục lạp heterokont rất giống lục lạp haptophyte, đều chứa một pyrenoid, ba chồng thylakoid và ở vài ngoại lệ[16] lớp màng epiplastid (lớp màng ngoài cùng, epi-: ngoài cùng) thông với mạng lưới nội chất. Giống như Haptophyta, Heterokontophyta cũng dự trữ tinh bột dưới dạng chrysolaminarin trong các hạt rải rác khắp tế bào chất.[16] Lục lạp heterokontophyte chứa diệp lục a và vài trường hợp ngoại lệ[16] chứa diệp lục c,[18] ngoài ra còn có thêm sắc tố carotenoid mang lại cho nó nhiều màu sắc khác nhau.[30]
Apicomplexa sửa
Apicomplexa (số ít tiếng Anh: apicomplexan) là một ngành trong siêu nhóm ngang giới Chromalveolata. Giống như Helicosproidia (một chi Tảo lục ký sinh trong đường ruột côn trùng), chúng cũng là một nhóm nguyên sinh vật ký sinh, và chứa loại lục lạp mất khả năng quang hợp.[29] Chúng từng được cho là có quan hệ họ hàng với Helicosproidia, nhưng với hiểu biết hiện nay, Helicosproidia gần với Tảo lục hơn là siêu nhóm Chromalveolata.[29] Ngành Apicomplexa có chi Plasmodium (chi Ký sinh trùng sốt rét). Nhiều loài Apicomplexa có một lục lạp thoái hóa nguồn gốc tảo đỏ[28][29] gọi là apicoplast, thừa hưởng từ tổ tiên của chúng. Còn những loài Apicomplexa khác như Cryptosporidium (một chi của Apicomplexa gây ra các bệnh tiêu hóa và hô hấp như tiêu chảy và ho dai dẳng) hoàn toàn mất đi lục lạp.[28] Apicomplexa dự trữ năng lượng của chúng dưới dạng các hạt tinh bột amylopectin nằm trong tế bào chất, dù cho chúng thuộc nhóm sinh vật không quang hợp.[16]
Apicoplast hoàn toàn không thể quang hợp, và nó cũng không chứa các sắc tố quang hợp hay các cấu trúc thylakoid đúng nghĩa. Apicoplast có 4 lớp màng, nhưng hệ thống màng của nó lại không kết nối với mạng lưới nội chất.[16] Thực tế cho thấy Apicomplexa vẫn giữ lại loại lục lạp đã mất khả năng quang hợp này, chứng tỏ rằng lục lạp vẫn còn thực hiện nhiều chức năng khác quan trọng hơn quang hợp. Trong tế bào thực vật, lục lạp cung cấp nhiều lợi ích thiết yếu bên cạnh việc sản xuất tinh bột, và apicoplast tất nhiên cũng không khác mấy—chúng có thể tổng hợp được các acid béo, isopentenyl pyrophosphate, các cụm sắt-lưu huỳnh, và tham gia một phần vào quá trình hình thành các heme.[28] Điều này cho thấy apicoplast là một đích ngắm hấp dẫn của ngành dược trong việc tạo ra các loại thuốc chữa trị các bệnh do Apicomplexa gây ra.[26] Chức năng quan trọng nhất của apicoplast là sản xuất isopentenyl pyrophosphate (một chất trung gian và cũng là sản phẩm trong quá trình mevalonate hóa, tham gia tổng hợp nên terpene và terpenoid—một nhóm gồm khoảng 30.000 hoạt chất sinh học)—thực tế cho biết Apicomplexa chết đi khi có gì đó cản trở hoạt động của apicoplast, và khi Apicomplexa nuôi cấy trong một môi trường giàu isopentenyl pyrophosphate thì nó cũng tiêu biến đi loại bào quan này (vì không còn cần thiết nữa).[28]
Dinophyta sửa
Dinoflagellata (số ít tiếng Anh: dinoflagellate, đồng nghĩa với Dinophyta, số ít tiếng Anh: dinophyte) là một nhóm sinh vật nguyên sinh rất lớn và phong phú, một nửa trong số đó có khả năng hay một phần khả năng quang hợp (sinh vật tạp dưỡng).[30][39]
Phần lớn lục lạp dinophyte thuộc loại lục lạp cấp hai nguồn gốc tảo đỏ, tương tự như lục lạp chromalveolate. Nhiều loài Dinophyta khác đã mất đi lục lạp của mình (trở thành nhóm không quang hợp trong ngành Dinoflagellata), hoặc thay thế nó thông qua quá trình nội cộng sinh lần thứ ba[40]—xảy ra khi một tế bào chromalveolate chứa lục lạp nguồn gốc tảo đỏ bị nuốt chửng và hòa hợp. Những loài Dinophyta còn lại thay thế lục lạp ban đầu của mình bằng loại lục lạp nguồn gốc tảo lục.[18][29][39]
Hầu hết lục lạp dinophyte đều chứa ít nhất các sắc tố quang hợp sau: diệp lục a, diệp lục c2, beta-carotene, và có thêm ít nhất một loại xanthophyll dinophyte đặc trưng (peridinin, dinoxanthin, hoặc diadinoxanthin), mang lại cho nó màu vàng nâu.[39] Tất cả Dinophyta đều lưu trữ tinh bột của mình trong các hạt rải rác khắp tế bào chất, và hầu hết chứa loại lục lạp mang ba chồng thylakoid.[16]
Lục lạp dinophyte chứa peridinin sửa
Loại lục lạp dinophyte phổ biến nhất là lục lạp chứa peridinin, đặc trưng bởi sự góp mặt của sắc tố carotenoid peridinin, cùng với diệp lục a và diệp lục c2.[18][39] Peridinin không thể tìm thấy trong một nhóm lục lạp nào khác.[39] Lục lạp (chứa) peridinin bao bọc bởi 3 lớp màng (thỉnh thoảng là 2),[16] còn lớp màng tế bào của tổ tiên là tảo đỏ nội cộng sinh đã mất đi.[18][29] Màng lục lạp ngoài cùng cũng không kết nối với mạng lưới nội chất.[16][39] Lục lạp này chứa một pyrenoid và ba chồng thylakoid. Tinh bột được tìm thấy bên ngoài lục lạp.[16] Một đặc trưng quan trọng của loại lục lạp này là DNA của chúng thu gọn cao độ và phân tán thành nhiều vòng nhỏ. Hầu hết các gen của lục lạp đã chuyển vào nhân tế bào, chỉ còn lại những gen liên quan đến quá trình quang hợp.[39]
Lục lạp peridinin được cho là lục lạp "chính gốc" của Dinophyta,[39] chúng đã mất đi, thoái hóa, thay thế hay chung hợp trong một vài dòng dinophyte.[29]
Lục lạp dinophyte chứa fucoxanthin (lục lạp dinophyte nguồn gốc haptophyte) sửa
Những dòng dinophyte (chứa) fucoxanthin (bao gồm Karlodinium và Karenia)[29] đã mất đi lục lạp nguồn gốc tảo đỏ ban đầu của chúng, và thay thế bằng một loại lục lạp mới nguồn gốc từ tảo haptophyte nội cộng sinh. Karlodinium và Karenia có lẽ đã bắt giữ và hòa hợp những loại Haptophyta khác nhau.[29] Bởi vì lục lạp haptophyte có 4 lớp màng, quá trình nội cộng sinh lần thứ ba dự kiến tạo ra tới 6 lớp màng cho lục lạp, bổ sung thêm lớp màng của chính tế bào haptophyte nội cộng sinh và màng thực bào của dinophyte.[42] Tuy nhiên, tế bào tảo haptophyte đã thoái hóa đi nhiều trong quá trình này, tước đi một ít màng và cả nhân của nó, chỉ để lại mỗi lục lạp (tất nhiên là lục lạp vẫn còn hai màng gốc của mình) và có khả năng có thêm một hoặc hai màng bao quanh nữa.[29][42]
Lục lạp chứa fucoxanthin đặc trưng bởi sắc tố xanthophyll fucoxanthin (chính xác là 19′-hexanoyloxy-fucoxanthin và/hoặc 19′-butanoyloxy-fucoxanthin) và không có sắc tố peridinin. Fucoxanthin cũng tìm thấy trong lục lạp loài tảo haptophyte, đây là một minh chứng cho việc lục lạp dinophyte chứa fucoxanthin có nguồn gốc từ tảo haptophyte nội cộng sinh.[39]
Lục lạp dinophyte nguồn gốc cryptophyte sửa
Những loài thuộc chi Dinophysis (một chi ngành Dinophyta) có một lục lạp chứa phycobilin[42] nguồn gốc từ tảo cryptophyte.[18] Nhưng sự thực, tế bào cryptophyte lại không phải là tế bào nội cộng sinh—chỉ có lục lạp của nó là bị lấy đi, và lục lạp này đã tước bỏ mất cấu trúc nucleomorph cũng như hai lớp màng ngoài cùng, kết quả là trở thành lục lạp màng kép (còn giữ lại lớp màng kép gốc). Lục lạp cryptophyte yêu cầu phải có nucleomorph mới có thể duy trì hoạt động của nó, vì vậy mà các loài Dinophysis (chứa loại lục lạp cryptophyte tước mất nucleomorph) nuôi cấy đơn độc một mình thì không thể sống sót, do đó (điều này chưa được xác minh) chứng tỏ lục lạp Dinophysis là một kleptoplast (lục lạp tạm thời)—nếu như vậy, khi lục lạp mất đi thì các loài Dinophysis sẽ phải tìm lấy và hòa hợp các tảo Cryptophyta để có được lục lạp mới thay thế cho cái cũ. Đây gọi là hiện tượng cộng sinh kleptoplastidy.[39]
Lục lạp dinophyte nguồn gốc tảo cát sửa
Một số dinophyte, như Kryptoperidinium và Durinskia[29] có một lục lạp nguồn gốc tảo cát (một lớp của ngành Heterokontophyta).[18] Loại lục lạp này bao bọc tối đa bởi 5 lớp màng,[18] (có thể ít hơn, tùy thuộc vào quan điểm của từng người, bao gồm trường hợp xem lục lạp là cả tế bào tảo cát nội cộng sinh, hoặc chỉ tương đương với lục lạp nguồn gốc tảo đỏ bên trong tế bào tảo cát). Trong quá trình này, tế bào tảo cát nội cộng sinh thoái hóa đi đôi chút—nhưng nó vẫn giữ lại các ty thể ban đầu của nó,[29] và còn có cả lưới nội chất, ribosome, một nhân và tất nhiên là phải còn bào quan lục lạp nguồn gốc tảo đỏ—đây rõ ràng là một tế bào tương đối hoàn chỉnh,[43] và tất cả chúng đều nằm gọn trong hệ thống xoang ống mạng lưới nội chất tế bào chủ.[29] Tuy nhiên tế bào tảo cát nội cộng sinh lại không thể dự trữ tinh bột của chính nó tạo ra—vì vậy lượng tinh bột này sẽ tống thành các hạt rải rác khắp nguyên sinh chất tế bào chủ.[16][43] Nhân tế bào tảo cát vẫn còn tồn tại, nhưng có lẽ không nên gọi là một nucleomorph, nguyên nhân là do nó không hề có dấu hiệu thoái hóa bộ gen, và thậm chí còn có thể đã mở rộng thêm[29] (khác với bản chất thuật ngữ nucleomorph ám chỉ tàn tích phần nhân còn sót lại). Tảo cát từng bị các dinophyte nuốt chửng và hòa hợp ít nhất ba lần.[29]
Tế bào tảo cát nội cộng sinh chỉ bao bọc bởi một lớp màng,[39] bên trong nó có chứa các lục lạp màng 4 lớp. Giống như tổ tiên là tảo cát thực sự, lục lạp cũng có ba chồng thylakoid và vài pyrenoid.[43]
Trong một số chi của Dinophyta, lục lạp nguồn gốc tảo cát không hẳn là loại lục lạp duy nhất. Lục lạp chứa perinidin màng 3 lớp chính gốc vẫn còn đó, nhưng đã chuyển hóa thành cấu trúc đốm mắt (eyespot apparatus—tạm dịch: bộ máy đốm mắt—một loại bào quan cảm quang, cho phép tế bào cảm nhận được hướng và cường độ ánh sáng, hỗ trợ cho sự vận động của một số nguyên sinh vật như trùng roi xanh).[18][29]
Lục lạp dinophyte nguồn gốc prasinophyte (một lớp Tảo lục) sửa
Lepidodinium viride và cả những họ hàng của nó là các dinophyte bị mất đi lục lạp chứa peridinin ban đầu và thay thế bằng loại lục lạp nguồn gốc tảo lục (cụ thể hơn, đó là lớp tảo lục Prasinophyceae, còn prasinophyte là số ít tiếng Anh).[16][39] Lepidodinium là chi dinophyte duy nhất chứa loại lục lạp không bắt nguồn từ dòng lục lạp tảo đỏ (rhodoplast). Lục lạp này bao bởi hai lớp màng và không có nucleomorph—tất cả các gen trong nucleomorph đã chuyển hết vào nhân tế bào dinophyte.[39] Quá trình nội cộng sinh phát sinh nên loại lục lạp này là một chuỗi quá trình nội cộng sinh lần thứ nhất và thứ hai, chứ chưa đến lần thứ ba—tế bào nội cộng sinh trong quá trình này là một loại tảo lục chứa một lục lạp sơ cấp (đây là tế bào tổ tiên của lục lạp cấp hai sau này).[29]
Chromatophore (tế bào sắc tố) sửa
Trong khi hầu hết các lục lạp đều có nguồn gốc từ chuỗi quá trình nội cộng sinh đầu tiên (thứ nhất, thứ hai và thứ ba), thì Paulinella chromatophora là một trường hợp ngoại lệ, bởi nó chỉ vừa hòa hợp được một vi khuẩn lam quang hợp nội cộng sinh trong thời gian gần đây. Chưa thể chắc chắn rằng vi khuẩn nội cộng sinh đó có mối quan hệ mật thiết đến tổ tiên lục lạp ở các sinh vật nhân thực khác hay không.[18] Do đang trong giai đoạn đầu của quá trình nội cộng sinh, Paulinella chromatophora có thể cung cấp cho chúng ta một số hiểu biết về cách mà lục lạp tiến hóa.[23][44] Những tế bào Paulinella chứa một hoặc hai cấu trúc quang hợp màu lục lam hình xúc xích gọi là chromatophore (thực chất đây là tế bào sắc tố),[23][44] tế bào con này là hậu duệ từ vi khuẩn lam Synechococcus nội cộng sinh trước đó. Tế bào sắc tố không thể tồn tại bên ngoài tế bào chủ.[23] DNA tế bào sắc tố dài khoảng một triệu cặp base, chứa khoảng 850 gen mã hóa protein—ít hơn ba triệu cặp base so với bộ gen của Synechococcus,[23] nhưng lớn hơn nhiều (xấp xỉ 150.000 cặp base) so với bộ gen của loại lục lạp hoàn thiện hơn.[45][46][47] Tế bào sắc tố đã chuyển một lượng nhỏ DNA của chúng vào nhân tế bào chủ. Khoảng chừng 0,3—0,8% DNA của nhân Paulinella đến từ tế bào sắc tố, so với con số 11—14% đến từ lục lạp trong tế bào thực vật.[44]
Hiện tượng cộng sinh kleptoplastidy sửa
Trong một vài nhóm nguyên sinh vật tạp dưỡng, như một số loài dinoflagellate, lục lạp được lấy từ một tế bào tảo bị bắt giữ hay từ tảo cát, và chỉ sử dụng tạm thời (ngay lúc này nó đang là thực thể nội cộng sinh với tế bào chủ). Những lục lạp tạm thời này (klepto chloroplast hay kleptoplast) chỉ tồn tại vài ngày và sau đó sẽ bị thay mới.[48]
DNA lục lạp sửa
Lục lạp sở hữu DNA của riêng chúng,[49] gọi là DNA lục lạp (chloroplast DNA), thường viết tắt thành ctDNA,[50] hoặc cpDNA.[51] Nó cũng được biết đến với cái tên plastome (bắt nguồn từ hai từ: plastid—lạp thể và genome—bộ gen, hệ gen, tạm dịch: bộ gen lạp thể). Sự tồn tại của nó chứng minh lần đầu vào năm 1962,[45] và được giải mã đầu tiên vào năm 1986—khi hai nhóm nghiên cứu người Nhật Bản tiến hành giải mã DNA lục lạp của rêu tản và thuốc lá.[52] Kể từ đó, hàng trăm bộ DNA lục lạp từ nhiều loài khác nhau đã giải mã trình tự, nhưng phần lớn là thực vật đất liền và các loại tảo lục, tảo lục lam, tảo đỏ, và những nhóm tảo khác với rất ít đại diện, điều này có thể gây ra một số thiên lệch trong quan điểm cấu trúc "điển hình" của DNA lục lạp cũng như thông tin di truyền chứa trong nó.[53]
Cấu trúc phân tử sửa
Trừ một vài ngoại lệ, toàn bộ hệ gen của phần lớn lục lạp nằm gọn trong một phân tử DNA mạch vòng duy nhất,[53] thường dài khoảng 120.000–170.000 cặp base.[45][46][47] Chu vi khoảng 30–60 micromet (μm), và khối lượng phân tử khoảng 80–130 triệu amu (đvC hay u).[54]
Thông thường, các phân tử DNA lục lạp được cho là mạch vòng, nhưng một số bằng chứng còn cho thấy chúng thường có thêm dạng mạch thẳng.[53][55]
Trình tự lặp lại đảo ngược sửa
Nhiều DNA lục lạp chứa hai trình tự lặp lại đảo ngược (inverted repeat – IR) hay đoạn lặp (lại) đảo ngược, ngăn cách vùng sao chép đơn dài (long single copy section – LSC) và vùng sao chép đơn ngắn (short single copy section – SSC).[47] Bình thường, một cặp trình tự lặp lại đảo ngược hiếm khi giống nhau hoàn toàn, nhưng ở DNA lục lạp, thật ngạc nhiên là chúng rất giống nhau, đây rõ ràng là một hệ quả của quá trình tiến hóa phối hợp (concerted evolution).[53]
Chiều dài của những đoạn lặp đảo ngược khác nhau rất lớn, chênh lệch từ 4.000 đến 25.000 cặp base và chứa từ 4 đến hơn 150 gen.[53] Các trình tự lặp lại đảo ngược ở tế bào thực vật thường dẫn đầu về chiều dài trong giới hạn này, từ 20.000–25.000 cặp base.[47][56]
Những trình tự lặp lại đảo ngược được giữ lại cao trong các loài thực vật đất liền, và có tích lũy thêm ít đột biến.[47][56] Tương tự những đoạn lặp đảo ngược tồn tại trong hệ gen vi khuẩn lam và hai dòng lục lạp khác (tảo đỏ và tảo lục lam), những trình tự này cũng xuất hiện trước lục lạp.[53] Một số DNA lục lạp làm mất đi[56][57] hoặc đảo lại những đoạn lặp lại đảo ngược (trở thành các đoạn lặp (lại) nguyên bản—direct repeat, không còn đặc tính đảo ngược nữa).[53] Thực tế có thể thấy rằng những trình tự lặp lại đảo ngược giúp ổn định tốt hơn cấu trúc hệ gen lục lạp, vì vậy mà những DNA lục lạp mất đi một số trình tự này thường có xu hướng sắp xếp lại.[57]
Thể nhân sửa
Những lục lạp mới sinh có thể chứa đến 100 bản sao DNA,[45] và số lượng sẽ giảm còn khoảng 15–20 bản sao tùy theo độ tuổi.[58] Các DNA thường gom lại và đóng gói trong các thể nhân (hay vùng nhân—nucleoid), có khả năng chứa một số vòng DNA giống hệt nhau. Mỗi lục lạp có thể có nhiều thể nhân.[54] Trong lục lạp tế bào tảo đỏ nguyên thủy, thể nhân tập trung tại vùng trung tâm, còn ở cây xanh và tảo lục, các thể nhân phân tán rải rác khắp chất nền stroma.[59]
Mặc dù các DNA lục lạp không kết hợp với loại protein histone thực sự,[10] nhưng trong tảo đỏ, vẫn tìm thấy các protein tương tự có khả năng đóng chặt các vòng DNA thành thể nhân.[59]
Quá trình nhân đôi DNA sửa
Mô hình điển hình của quá trình nhân đôi cpDNA sửa
Cơ chế của quá trình nhân đôi DNA lục lạp chưa được xác định một cách thuyết phục, nhưng có hai mô hình chính đã đề xuất (đề mục này đang nói về Mô hình điển hình nhất trong đó). Các nhà khoa học đã cố gắng quan sát quá trình phân đôi (trực phân) lục lạp qua kính hiển vi điện tử từ những năm 1970.[60][61] Kết quả của những thí nghiệm này đưa đến ý tưởng rằng DNA lục lạp nhân đôi bằng cách sử dụng một cấu trúc gọi là thòng lọng (tạo bởi) mạch kép tách nhau hay thòng lọng D, vòng D (double displacement loop, D-loop). Khi thòng lọng D mở rộng dọc theo vòng DNA (tháo xoắn và tách mạch dần chuỗi DNA), nó sẽ hình thành nên dạng cấu trúc trung gian theta (θ), còn biết đến với cái tên cấu trúc trung gian Cairns, và hoàn thành việc nhân đôi sau khi bổ sung xong các nucleotide dọc theo hai mạch gốc DNA.[60][62] Sự sao chép bắt đầu từ những điểm gốc xác định. Tại đó, nhiều chạc tái bản dần xuất hiện, cho phép bộ máy nhân đôi tiến hành sao chép DNA. Tiếp theo, các chạc tái bản liên tiếp mở rộng và cuối cùng thông hết với nhau. Hai vòng xoắn kép cpDNA gồm các mạch mới tổng hợp tách ra và hoàn thiện dần để hình thành nên các nhiễm sắc thể cpDNA sau này.
Bên cạnh những minh chứng từ những thí nghiệm hiển vi đầu tiên, mô hình này cũng được củng cố bởi một lượng quá trình khử amine hóa (deamine hóa) tìm thấy trong cpDNA[60] (vì đây là mô hình có những điều kiện thuận lợi dẫn đến quá trình trên). Khử amine hóa xảy ra khi một nhóm amino mất đi và dẫn đến hệ quả là đột biến thay thế các base. Khi adenine bị khử amine hóa, nó chuyển thể thành hypoxanthine (ký hiệu: H). Qua lần nhân đôi DNA đầu, hypoxanthine có thể bổ sung với cytosine để trở thành cặp base H-C, và sau một lần nhân đôi DNA nữa, C tiếp tục bắt đôi với G để trở thành cặp G-C (vậy là, từ một cặp base A-T lúc đầu sau đột biến khử amine đã trở thành cặp G-C, và trên cùng một mạch gốc ban đầu, base A trở thành base G thông qua trung gian H).[63]
Quá trình khử amine hóa sửa
Theo mô hình điển hình, trong cpDNA, có một số thuận lợi dẫn đến khuynh hướng khử amine hóa A → G. DNA dễ dàng bị khử amine hóa khi tách thành những mạch đơn tự do không liên kết với nhau. Theo tiến trình mở rộng các chạc ba tái bản, có những mạch chưa kịp sao chép vẫn còn ở trạng thái mạch đơn tự do và chúng có nguy cơ xảy ra sự khử amine hóa A → G. Vì vậy, khuynh hướng của quá trình khử amine hóa biểu hiện thông qua các sơ hở của chạc tái bản là có khả năng nhất hiện tại, và định hướng này cũng được củng cố thêm khi các mạch đơn chưa kịp sao chép đó có thể giữ trạng thái tự do trong một khoảng thời gian dài.[60] Mô hình này vẫn đang là một giả thuyết hàng đầu hiện nay; tuy nhiên, một mô hình thứ hai cũng gợi ý rằng thực sự phần lớn cpDNA có dạng mạch thẳng và quá trình nhân đôi tiến hành thông qua sự tái tổ hợp tương đồng. Nó cũng cho biết chỉ có một thiểu số vật chất di truyền lưu giữ trong các nhiễm sắc thể dạng vòng, trong khi phần còn lại có thể có trong các dạng mạch thẳng, phân nhánh hay những cấu trúc phức tạp khác.[60][62]
Mô hình thay thế sửa
Một mô hình cạnh tranh khác của quá trình nhân đôi cpDNA khẳng định rằng phần lớn cpDNA có dạng mạch thẳng và sự nhân đôi tiến hành thông qua quá trình tái tổ hợp tương đồng, tương tự thực khuẩn thể T4[62] (bacteriophage T4). Mô hình này được đề xuất dựa trên việc phát hiện một số loài thực vật có cpDNA mạch thẳng, chẳng hạn như ngô, và có thể có nhiều loài khác chứa thêm những cấu trúc di truyền phức tạp hơn mà các nhà khoa học chưa thể hiểu rõ.[62] Qua những thí nghiệm ban đầu trên cpDNA, những nhà khoa học từng chú ý đến các cấu trúc mạch thẳng này; tuy nhiên, họ cho rằng đó chỉ là hệ quả của những vòng DNA vỡ hỏng.[62] Nếu các cấu trúc di truyền phân nhánh và phức tạp tìm thấy trong những thí nghiệm trên cpDNA là sự thật và không phải là hệ quả của dạng DNA chuỗi vòng (gồm các vòng DNA nối tiếp nhau) hoặc vỡ hỏng, thì cơ chế nhân đôi sử dụng những thòng lọng D (mô hình điển hình) là không đủ để giải thích việc tạo ra những cấu trúc như trên.[62] Đồng thời, sự tái tổ hợp tương đồng cũng không mở rộng hỗ trợ cho khuynh hướng đột biến khử amine hóa A → G tìm thấy trong hệ gen lục lạp.[60] Do thất bại trong việc giải thích khuynh hướng khử amine hóa cũng như vô số các loài thực vật được chứng minh có loại DNA vòng, giả thuyết của mô hình điển hình đã chiếm ưu thế hơn, tiếp tục cho rằng hầu hết cpDNA có dạng vòng và phần lớn nhân đôi thông qua cơ chế thòng lọng D.
Thông tin di truyền và sự tổng hợp protein sửa
Thông thường, bộ gen lục lạp chứa khoảng 100 gen[24][46] mã hóa cho nhiều cấu trúc đa dạng, trong đó phần lớn liên quan đến sự sinh tổng hợp protein và quá trình quang hợp. Tương tự tế bào nhân sơ, DNA lục lạp cũng tổ chức các gen của nó thành các operon.[24] Điều thú vị là không giống như các phân tử DNA tế bào nhân sơ, DNA lục lạp có chứa các intron (DNA ty thể (mtDNA) ở thực vật cũng vậy, nhưng ở người thì lại không).[64]
Thông tin di truyền của bộ gen lục lạp trong các loài thực vật đất liền gần như tương tự nhau.[47]
Quá trình thu gọn bộ gen lục lạp và sự chuyển gen sửa
Theo thời gian, nhiều thành tố của hệ gen lục lạp đã chuyển đến hệ gen nhân tế bào chủ,[45][46][65] đây được gọi là quá trình chuyển gen nội cộng sinh. Kết quả là bộ gen lục lạp bị thu gọn cao độ, nhỏ hơn nhiều so với vi khuẩn lam sống tự do. Lục lạp có thể chứa 60–100 gen, trong khi vi khuẩn lam thường chứa nhiều hơn 1.500 gen trong bộ gen của chúng.[66] Gần đây, một loại lạp thể không có hệ gen đã được tìm thấy, chứng tỏ lục lạp có thể mất luôn hệ gen của nó trong quá trình chuyển gen nội cộng sinh.[67]
Chuyển gen nội cộng sinh có ý nghĩa giúp chúng ta hiểu hơn về hiện tượng biến mất lục lạp ở nhiều dòng chromalveolate. Ngay cả khi lục lạp cuối cùng mất đi, các gen mà nó đã chuyển cho các tế bào chủ trước đó có thể cung cấp những bằng chứng về sự tồn tại các lục lạp đã mất. Ví dụ, dù trong tảo cát (một heterokontophyte) hiện đang có một lục lạp nguồn gốc tảo đỏ, nhưng sự hiện diện của nhiều gen tảo lục trong nhân tế bào của chúng đã cung cấp chứng cứ cho thấy tổ tiên tảo cát (có thể cũng là tổ tiên của tất cả các loài chromalveolate) có lục lạp nguồn gốc tảo lục ở một số giai đoạn tiến hóa, và sau cùng thay bằng loại lục lạp nguồn gốc tảo đỏ.[37]
Ở thực vật đất liền, một hàm lượng khoảng 11–14% DNA trong nhân tế bào có thể có nguồn gốc từ lục lạp,[44] riêng cải Arabidopsis lên đến 18%, tương ứng với khoảng 4.500 gen mã hóa protein.[68] Đã có một vài quá trình chuyển gen gần đây từ DNA lục lạp đến hệ gen nhân tế bào thực vật đất liền.[46]
Xấp xỉ 3.000 protein tìm thấy trong lục lạp, khoảng 95% mã hóa bởi các gen trong nhân. Nhiều phức hệ protein cấu tạo từ các tiểu đơn vị được tổng hợp từ cả hai hệ gen lục lạp và nhân tế bào. Vì vậy, lục lạp lẫn nhân phải cùng phối hợp với nhau để hoàn chỉnh quá trình sinh tổng hợp protein. Lục lạp hoạt động chủ yếu dưới sự kiểm soát của nhân tế bào, nhưng đôi khi nó có thể phát xuất những tín hiệu điều hòa biểu hiện các gen trong nhân, đây gọi là hiện tượng truyền tín hiệu ngược (retrograde signaling).[69]
Sinh tổng hợp protein sửa
Sinh tổng hợp protein trong lục lạp hoạt động với sự tham gia của hai loại enzyme RNA polymerase. Một mã hóa bởi DNA lục lạp, còn một có nguồn gốc từ nhân. Cả hai RNA polymerase này có thể nhận biết và liên hợp với nhiều loại vùng khởi đầu (hay vùng khởi động—promoter) trong bộ gen lục lạp.[70] Các ribosome lục lạp tương tự ribosome vi khuẩn.[71]
Sự hướng đích và nhập lại protein sửa
Do có nhiều gen cpDNA chuyển vào nhân tế bào, nên nhiều protein từng dịch mã trong lục lạp hiện được tổng hợp ngay trong tế bào chất tế bào thực vật. Những protein này sẽ phải nhập trở lại lục lạp và kinh qua ít nhất hai lớp màng.[72]
Kì lạ thay, khoảng một nửa trong số các sản phẩm protein của gen chuyển đi (transferred gene) lại không định hướng trở về lục lạp. Phần nhiều chuyển thành dạng thích nghi linh hoạt (exaptation), tham gia vào các chức năng mới như phân bào, định tuyến protein hay cả khả năng kháng bệnh. Một vài gen lục lạp tìm thấy nơi cư ngụ mới ở hệ gen ty thể—phần lớn đã trở thành các gen giả (pseudogene) không mang chức năng, mặc dù một ít gen tRNA vẫn còn hoạt động.[66] Một số sản phẩm protein của DNA lục lạp chuyển đi tham gia vào lộ trình chế tiết[66] (secretory pathway: một chuỗi những hoạt động dẫn đến kết quả cuối cùng là bài tiết protein ra ngoài tế bào). Cần lưu ý rằng nhiều lục lạp cấp hai có lớp màng ngoài cùng nguồn gốc từ màng tế bào chủ mà nó nội cộng sinh, và theo quan điểm tô pô học về không gian bên ngoài tế bào (lúc này không gian bên ngoài chứa chất nền ngoại bào của tế bào chủ "thống nhất" với không gian bên ngoài lớp màng ngoài cùng của lục lạp cấp hai hay chính xác là tế bào chất chứa bào tương của chính tế bào đó, bởi vì cả hai không gian này đều có cùng đặc tính "nằm ngoài" lớp màng tế bào chủ), vì vậy muốn đến được lục lạp từ bào tương, những sản phẩm protein phải băng qua lớp màng tế bào, giống như vừa mới hướng đích tới chất nền ngoại bào. Trong trường hợp thú vị này, protein hướng đích lục lạp thực ra đang "chu du" xuyên suốt lộ trình chế tiết (dù không thực sự bài tiết ra "ngoài").[29]
Trong các tế bào chứa lục lạp sơ cấp thuở ban sơ thực tế luôn có sẵn ty thể (và peroxisome, và lớp màng tế bào phục vụ lộ trình chế tiết), do đó những thế hệ tế bào mới sau này đã phát triển một hệ thống hướng đích protein độc nhất để tránh việc các protein lục lạp gửi nhầm đến các bào quan khác, cũng như nhận nhầm những protein không của lục lạp.[72]
Phần lớn, không hẳn tất cả trường hợp, các protein lục lạp mã hóa từ nhân đều bổ sung một peptide tín hiệu vào đầu N của tiền protein (protein sơ khai) trong quá trình dịch mã. Đôi khi, những trình tự vận chuyển cũng được tìm thấy tại đầu C,[74] hay có thể đóng một vai trò nào đó trong chức năng protein.[72]
Protein vận chuyển và kênh xuyên màng sửa
Sau khi một chuỗi polypeptide lục lạp tổng hợp tại ribosome trong bào tương, một loại enzyme đặc hiệu sẽ tiến hành phosphoryl hóa cấu trúc phân tử để trở thành protein lục lạp,[75] tức là bổ sung một nhóm phosphate vào nhiều (không phải tất cả) trình tự vận chuyển của chúng.[72] Quá trình phosphoryl hóa giúp nhiều protein khác nhau kết nối với đoạn polypeptide, giúp nó đạt trạng thái gấp xoắn từ sớm.[72] Điều này quan trọng bởi vì nó ngăn chặn protein lục lạp tự hoạch định dạng hoạt động của chúng và thực hiện chức năng lục lạp trong một khu vực không đúng—bào tương tế bào.[76][77] Đồng thời, những chuỗi polypepide này cũng phải giữ hình thù ở mức phù hợp để lục lạp có thể nhận biết.[76] Những protein kết nối cũng sẽ giúp các đoạn polypeptide hướng đích nhập lại lục lạp.[72]
Lúc này, những protein lục lạp muốn vào được chất nền stroma phải kinh qua hai phức hệ protein xuyên màng, gồm: translocon màng lục lạp ngoài hay phức hệ TOC, viết tắt từ: translocon on the outer chloroplast membrane và translocon màng lục lạp trong hay phức hệ TIC, viết tắt từ: translocon on the inner chloroplast membrane.[72] Những chuỗi polypeptide thường băng qua hai phức hệ này cùng một lúc, nhưng các kênh xuyên màng trong vẫn tìm lấy và thông qua những tiền protein còn phiêu bạt trong xoang gian màng.[72]
Cấu trúc sửa
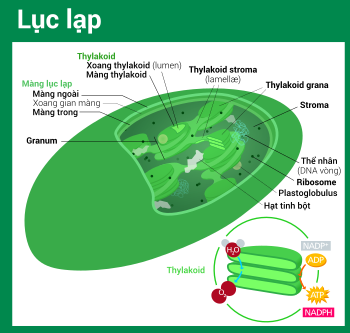
Ở thực vật đất liền, lục lạp thường có hình thấu kính lồi (gần với hình bầu dục), đường kính 5–8 μm và dày 1–3 μm.[78] Ở tảo, lục lạp có nhiều hình thù đa dạng hơn, thường chỉ chứa một lục lạp duy nhất,[16] từ hình lưới (vd. Oedogonium),[79] hình cốc (vd. Chlamydomonas),[80] hình đai xoắn (vd. Sirogonium)[81] và cả hình ruy băng xoắn phủ khắp tế bào (vd. Spirogyra).[82] Một số loại tảo có hai lục lạp trong tế bào, hình sao như Zygnema,[83] hay lấp đầy phân nửa tế bào từ hai cực như bộ Desmidiales.[84] Ở vài loại tảo, lục lạp chiếm phần lớn thể tích tế bào, bao lấy luôn cả nhân và các bào quan khác[16] (thí dụ như một số loài chi Chlorella có lục lạp hình cốc chiếm hầu hết không gian nội bào).[85]
Tất cả lục lạp đều có ít nhất ba hệ thống màng: màng lục lạp ngoài, màng lục lạp trong và hệ thống thylakoid. Loại lục lạp nguồn gốc từ quá trình nội cộng sinh thứ cấp có thể xuất hiện thêm vài lớp màng bao quanh bên cạnh hệ thống ba màng này.[36] Phía trong lớp màng kép lục lạp là chất nền stroma, một chất dịch gần với trạng thái gel (nhớt),[26] tạo nên phần lớn sinh khối cho lục lạp, và chứa trong đó những cấu trúc trôi nổi khắp khối dịch.
Có một số quan niệm sai lầm phổ biến về màng ngoài và màng trong lục lạp. Thực tế, lục lạp được bao bọc bởi một lớp màng kép có bằng chứng nguồn gốc từ vi khuẩn lam nội cộng sinh. Trong khi bình thường, nhiều người lại hay hiểu theo nghĩa: màng lục lạp ngoài là lớp màng thực bào trích ra từ màng tế bào chủ bao quanh lấy tổ tiên là vi khuẩn lam, điều này không đúng sự thật, thực chất cả hai màng lục lạp đều tương đồng với hai màng lipid kép ban đầu của vi khuẩn lam Gram âm.[18]
Màng kép lục lạp cũng thường bị so sánh với màng kép ty thể. Đây không phải là một sự so sánh hợp lý, bởi vì màng trong ty thể được sử dụng để tạo ra cơ chế ngăn cách hình thành nên một gradient giúp các bơm proton hoạt động cũng như phục vụ quá trình phosphoryl hóa oxy hóa sản xuất hoạt chất cao năng ATP. Còn trong lục lạp, cấu trúc tương đương với chức năng màng trong ty thể lại là hệ thống màng thylakoid. Nhưng có đôi chút khác biệt, hướng gradient vận chuyển H+ ở lục lạp lại ngược lại so với ty thể (ở ty thể, H+ từ xoang gian màng đi vào chất nền; còn ở lục lạp, H+ từ xoang thylakoid tống ra chất nền).[26][86] Ngoài ra, về mặt chức năng, màng trong lục lạp chỉ được quy định tham gia một số công đoạn chuyển hóa và tổng hợp vài chất, hoàn toàn không tương ứng với vai trò màng trong ty thể.[26]
Màng lục lạp ngoài sửa
Màng lục lạp ngoài là một màng bán nhớt cho phép những phân tử nhỏ và ion khuếch tán dễ dàng.[87] Tuy nhiên, nó không thể thẩm thấu được những protein kích thước lớn, vì vậy những chuỗi polypeptide lục lạp tổng hợp trong tế bào chất phải lưu thông thông qua phức hệ TOC, hay translocon màng lục lạp ngoài, tiếng Anh: translocon on the outer chloroplast membrane.[72]
Các màng lục lạp đôi lúc nhô ra tế bào chất tạo nên cấu trúc stromule, nguồn gốc từ từ tiếng Anh: stroma-containing tubule (nghĩa đen: ống chứa dịch stroma). Stromule rất hiếm thấy trong lục lạp, nhưng thông dụng hơn nhiều ở các loại lạp thể khác như sắc lạp và lạp bột trong cánh hoa và hệ rễ.[88][89] Mục đích chúng tồn tại có thể để làm tăng diện tích bề mặt lục lạp phục vụ quá trình vận chuyển các chất qua màng, điển hình ở việc chúng thường tỏa nhánh và thông kết với mạng lưới nội chất.[90] Khi phát hiện lần đầu vào năm 1962, một số nhà thực vật học đã phủi tay bác bỏ, cho rằng cấu trúc đó chỉ là giả tạo, có thể là một hình thù kỳ quặc của lục lạp với những vùng thắt, hay là một dạng trung gian trong quá trình phân đôi lục lạp.[91] Nhưng thực tế, chúng luôn xuất hiện và phát triển liên tục, chứng tỏ stromule có vai trò không thể thiếu trong lạp thể tế bào thực vật, chẳng thể nào là giả tạo được.[92]
Xoang gian màng và thành peptidoglycan sửa
Bình thường, có một xoang gian màng dày khoảng 10–20 nanomet nằm giữa hai màng lục lạp trong và ngoài.[93]
Lục lạp tảo lục lam có một lớp thành peptidoglycan chắn giữa hai màng lục lạp. Nó tương đương với thành tế bào peptidoglycan của tổ tiên là vi khuẩn lam, cũng nằm giữa hai màng lipid kép của chúng. Loại lục lạp này được gọi là muroplast (từ tiếng Latin mura, có nghĩa là "thành, tường"). Còn những nhóm lục lạp khác đã thoái hóa đi lớp thành này, để lại một không gian rỗng gọi là xoang gian màng choán giữa màng trong và màng ngoài lục lạp.[26]
Màng lục lạp trong sửa
Màng lục lạp trong giáp với chất nền stroma, có vai trò quản lý sự lưu thông vật chất ra vào lục lạp. Sau khi thông qua phức hệ TOC trên màng lục lạp ngoài, những polypeptide phải tiếp tục xuyên qua phức hệ TIC (translocon on the inner chloroplast membrane hay translocon màng lục lạp trong), được đặt trên màng trong lục lạp.[72]
Ngoài việc quản lý quá trình vận chuyển các chất, màng lục lạp trong còn là nơi tổng hợp các acid béo, lipid và sắc tố carotenoid.[26]
Mạng lưới ngoại vi sửa
Một số lục lạp có loại cấu trúc mạng lưới ngoại vi lục lạp (chloroplast peripheral reticulum).[93] Nó thường tìm thấy trong lục lạp của thực vật C4, dù đôi lúc cũng có mặt trong thực vật hạt kín C3[26] hay thậm chí cả một số loài hạt trần.[94] Mạng lưới ngoại vi lục lạp là một mê cung cấu thành từ những ống và túi nối tiếp nhau liên kết với màng trong lục lạp, phát triển lấn vào khối dịch stroma. Vai trò của nó được cho là giúp tăng diện tích bề mặt lục lạp, hỗ trợ quá trình vận chuyển các chất qua màng giữa stroma và tế bào chất. Theo kết quả của một số quan sát, những túi nhỏ của mạng lưới ngoại vi có khả năng là những túi vận chuyển, đưa đón vật chất từ hệ thống thylakoid đến xoang gian màng và ngược lại.[95]
Stroma (chất nền) sửa
Stroma là chất dịch kiềm tính[86] giàu protein[26] lấp đầy không gian giữa màng lục lạp trong và hệ thống thylakoid,[26] tương ứng với bào tương tổ tiên—vi khuẩn lam. Thể nhân chứa cpDNA, ribosome lục lạp, hệ thống thylakoid, cùng với những giọt plastoglobuli, các hạt tinh bột và nhiều loại protein được tìm thấy trôi nổi trong chất nền này. Stroma còn là nơi xảy ra chu trình Calvin, cố định CO2 và chuyển hóa thành đường.
Ribosome lục lạp sửa
Lục lạp có loại ribosome riêng, được sử dụng để tổng hợp nên một lượng nhỏ protein của chúng. Ribosome lục lạp bằng 2/3 kích thước ribosome tế bào nhân thực (khoảng 17 nm so với 25 nm).[93] Chúng bắt lấy những chuỗi mRNA đã phiên mã từ DNA lục lạp và tiến hành dịch mã tổng hợp nên protein. Quá trình dịch mã ở lục lạp phức tạp hơn nhiều so với vi khuẩn,[10] vì vậy mà ribosome của chúng cũng sẽ có những chức năng chuyên biệt, không có ở ribosome vi khuẩn.[96] Những RNA ribosome trong tiểu phần nhỏ ở vài loại lục lạp Chlorophyta và euglenid thiếu đi những vị trí xác nhận trình tự Shine–Dalgarno,[97] được coi là cần thiết để khởi đầu dịch mã ở phần lớn lục lạp và sinh vật nhân sơ.[98][99] Sự thiết sót này hiếm khi quan sát thấy trong sinh vật nhân sơ và những nhóm lạp thể khác.[97][100]
Plastoglobuli sửa
Plastoglobuli (số ít plastoglobulus, đôi khi phát âm thành plastoglobule(s)) là những giọt hình cầu chứa lipid và protein[26] đường kính khoảng 45–60 nanomet.[101] Chúng được bao phủ bởi một lớp màng lipid đơn.[101] Plastoglobuli tìm thấy ở tất cả lục lạp,[93] nhưng trở nên đông đảo hơn trong những lục lạp bị mất cân bằng oxy hóa,[101] hay "có tuổi" và chuẩn bị chuyển thể thành lão lạp (gerontoplast).[26] Trong những trường hợp này, plastoglobuli cũng biến tướng phình to về kích thước.[101] Chúng cũng phổ biến trong các tiền lục lạp (etioplast), nhưng giảm dần số lượng khi etioplast "trưởng thành" lên lục lạp.[101]
Plastoglobuli chứa cả protein cấu trúc và enzyme, tham gia tổng hợp lipid và trao đổi chất. Chúng cũng chứa nhiều loại lipid, bao gồm plastoquinone, vitamin E, carotenoid và chlorophyll.[101]
Plastoglobuli từng được cho là những giọt trôi nổi tự do trong stroma, nhưng bây giờ, người ta nghĩ rằng nó luôn kết nối hoặc với một thylakoid hoặc với một plastoglobuli khác cũng đang kết nối với thylakoid, tạo nên một cấu hình cho phép mạng lưới plastoglobulus trao đổi thông tin với hệ thống thylakoid.[101] Trong lục lạp xanh lục bình thường, đại đa số các plastoglobuli khá đặc biệt, đính chặt trực tiếp vào thylakoid "cha mẹ" của chúng. Trong những lục lạp già hay mất cân bằng oxy hóa, plastoglobuli có xu hướng liên kết với nhau thành nhóm hay chuỗi, tất nhiên là vẫn luôn neo lại với một thylakoid.[101]
Plastoglobuli hình thành khi một túi bóng xuất hiện giữa các lớp của màng lipid kép trong màng thylakoid, hay "nảy chồi" từ những giọt plastoglobuli có sẵn—dù cho chúng không bao giờ tách khỏi thylakoid và trôi dạt trong stroma.[101] Thông thường, tất cả plastoglobuli được tạo thành từ cách trên hoặc từ những dạng cong tròn cực độ của những túi dẹp hay phiến gian thylakoid. Chúng cũng bám phổ biến trên thylakoid stroma hơn là loại thylakoid grana.[101]
Hạt tinh bột sửa
Những hạt tinh bột có rất nhiều trong lục lạp, thường chiếm khoảng 15% thể tích bào quan,[102] thậm chí trong một số loại lạp thể khác như lạp bột, chúng có thể đủ lớn để định hình nên hình dạng bào quan.[93] Hạt tinh bột đơn giản chỉ là những hạt tích lũy tinh bột trong chất nền stroma, và không có màng bao bọc.[93]
Các hạt tinh bột liên tục sản sinh và lớn lên suốt ngày trong lúc lục lạp vận hành tổng hợp chất đường, và khi màn đêm buông xuống, chúng được tiêu thụ một phần làm nhiên liệu cho quá trình hô hấp và sau đó xuất vào mạch rây,[103] vì vậy trong lục lạp trưởng thành, hiếm khi có trường hợp một hạt tinh bột bị phân giải hoàn toàn cho quá trình hô hấp, hay chuyển đến các cơ quan dự trữ theo dòng mạch rây một hạt tinh bột nguyên vẹn mới sinh.[102]
Trong những dòng lục lạp khác nhau, các hạt tinh bột có thành phần và vị trí rất đa dạng. Ở tảo đỏ, chúng có nhiều trong tế bào chất hơn là lục lạp.[104] Còn ở thực vật C4, lục lạp tế bào thịt lá không tự tổng hợp đường và thiếu đi các hạt tinh bột.[26]
Rubisco sửa
Chất nền stroma chứa nhiều loại protein, trong số đó, protein phổ biến và quan trọng nhất chính là Rubisco, thậm chí cũng có thể là protein dồi dào nhất hành tinh.[86] Rubisco là một enzyme, có khả năng cố định CO2 thành đường. Ở thực vật C3, rubisco có mặt trong tất cả lục lạp, còn ở thực vật C4, nó chỉ chứa trong những dạng lục lạp tế bào bao bó mạch, nơi xảy ra chu trình Calvin.[105]
Pyrenoid sửa
Lục lạp ở một số loại rêu sừng[106] và tảo chứa cấu trúc gọi là pyrenoid. Nó không tìm thấy được ở thực vật bậc cao.[107] Pyrenoid là những thể hình cầu và khúc xạ mạnh, là tụ điểm tích lũy tinh bột. Chúng gồm có một ma trận dày đặc electron và bao bởi hai mảng tinh bột hình bán cầu. Tinh bột được tích lũy khi pyrenoid trưởng thành.[108] Với cơ chế tập trung carbon trong tảo, enzyme rubisco cũng tìm thấy trong các pyrenoid. Dù vậy, tinh bột vẫn có thể tích lũy quanh pyrenoid ngay cả khi CO2 khan hiếm.[107] Pyrenoid có khả năng phân chia thành những pyrenoid mới, hoặc sản sinh theo kiểu de novo (tổng hợp từ đầu).[108][109]
Hệ thống thylakoid sửa
Lơ lửng trong chất nền stroma là hệ thống thylakoid. Đây là một tập hợp những túi có màng bao rất linh động gọi là thylakoid, nơi tìm thấy diệp lục (chlorophyll) và xảy ra phản ứng sáng của quá trình quang hợp.[15] Trong phần lớn lục lạp thực vật có mạch, các thylakoid sắp xếp thành những chồng gọi là grana;[110] ngoài ra, ở một số lục lạp thực vật C4[105] và tảo, thylakoid còn tự do trôi nổi trong chất nền stroma.[16]
Cấu trúc grana sửa
Sử dụng một kính hiển vi quang học nhìn vào lục lạp, vừa đủ để nhận thấy những hạt bé li ti màu xanh—chúng được gọi là grana[93] (bắt nguồn từ granule, nghĩa là hạt; số ít: granum). Với kính hiển vi điện tử, người ta có thể quan sát chi tiết hơn hệ thống thylakoid, thấy được những chồng thylakoid phẳng dẹt tạo nên grana, và cả những phiến gian thylakoid stroma nối kết các chồng grana khác nhau.[93] Trong kính hiển vi điện tử truyền qua, màng thylakoid hiện lên như những dải xen kẽ sáng–tối, dày 8,5 nanomet.[93]
Trong một thời gian dài, những cấu trúc không gian ba chiều của hệ thống thylakoid vẫn chưa thể xác minh hay còn gây tranh cãi. Một mô hình thì mô phỏng granum tựa như một chồng chứa các túi thylakoid, liên kết với những phiến gian thylakoid stroma theo hình trôn ốc; một mô hình khác lại thể hiện granum như một thylakoid đơn nhất gập lại, kết nối với những grana khác thông qua thylakoid stroma theo hướng gần giống "trục và căm xe". Trong khi hệ thống thylakoid vẫn thường mô tả theo mô hình gấp lại,[15] thì đến năm 2011, mô hình chồng túi/trôn ốc mới được công nhận là đúng đắn.[111]
Theo mô hình thylakoid xoắn trôn ốc, grana là một chồng gồm các túi tròn dẹp thylakoid grana, tựa như một chồng tiền xu hay bánh kếp. Mỗi granum có thể chứa từ hai đến một trăm thylakoid,[93] còn 10–20 vẫn là con số phổ biến nhất.[110] Bao quanh grana là những thylakoid stroma, còn có tên là phiến gian hay tấm gian (lamellae, số ít: lamella). Vòng trôn ốc của thylakoid stroma xoắn theo một góc 20–25°, kết nối với thylakoid grana tương ứng thông qua những khe liên kết. Các vòng xoắn có thể mở rộng thành những phiến lớn liên kết qua lại nhiều grana, hay thu lại để tạo nên những cầu dạng ống trao đổi vật chất giữa các grana.[111] Trong hệ thống thylakoid, dù cho có sai khác về thành phần protein màng ở mỗi phần, nhưng các lớp màng thylakoid vẫn luôn thông liền liên tục với nhau, kết hợp với xoang thylakoid (lumen) cùng nhau tạo nên một "mê cung" nối tiếp thống nhất.[110]
Thylakoid sửa
Thylakoid (đôi khi phát âm thành thylakoïd),[112] là những cấu trúc dạng túi nhỏ có màng bao liên kết với nhau, đây là nơi xảy ra phản ứng sáng của quá trình quang hợp. Từ nguyên thylakoid xuất phát từ tiếng Hy Lạp thylakos, nghĩa là "cái túi".[113]
Khảm trên màng thylakoid là những phức hệ protein quan trọng thực hiện những phản ứng sáng phục vụ quá trình quang hợp. Quang hệ II và quang hệ I là hai trong số chúng, chứa những phức hệ hấp thụ ánh sáng cấu tạo từ các sắc tố chlorophyll và catenoid, chúng hấp thu năng lượng ánh sáng và sau đó sử dụng để kích hoạt các electron thành dạng hoạt động. Những phân tử trong màng thylakoid tiếp tục dùng những electron kích hoạt này cho việc bơm ion H+ vào xoang thylakoid, làm giảm độ pH và gây acid hóa. ATP synthase là một phức hệ protein lớn khác, có khả năng khai thác gradient nồng độ (sự chênh lệch nồng độ) của ion H+ giữa chất nền và xoang thylakoid, nhằm sản sinh năng lượng ATP bằng cách lợi dụng dòng chảy H+ từ xoang khuếch tán trở lại chất nền—hoạt động chẳng khác gì một turbine.[86]
Thylakoid gồm có hai loại: thylakoid grana và thylakoid stroma. Thylakoid grana là những túi dẹp xấp lên tạo nên chồng grana, còn thylakoid stroma là những phiến gian tiếp xúc với chất nền stroma. Thylakoid grana tựa như những đĩa bánh hình tròn đường kính khoảng 300–600 nanomet. Thylakoid stroma dạng như những tấm mỏng xoắn trôn ốc bọc quanh grana.[110] Chóp và đáy của thylakoid grana tương đối phẳng, trên đó có chứa các phức hệ protein quang hệ II. Tính phẳng này cho phép chúng có thể sắp xếp khăng khít với nhau, tạo nên chồng grana với nhiều lớp màng siết chặt qua lại, gọi là màng trong grana (gồm phần mặt trên và mặt dưới của màng thylakoid grana), giúp tăng tính ổn định cũng như diện tích bề mặt cho hoạt động "bắt giữ" ánh sáng.[110]
Thay vì đặt trong lòng grana như quang hệ II, những phức hệ protein lớn khác như quang hệ I và ATP synthase lại được định vị tại những vị trí tiếp xúc chất nền stroma. Chúng không phù hợp với lớp màng trong grana siết chặt, vì vậy ở những lớp màng tiếp xúc stroma chúng mới hiện diện và được tìm thấy. Màng tiếp xúc stroma này chính là các mép thoai thoải vòng quanh của màng thylakoid grana cùng với toàn bộ màng thylakoid stroma. Những phức hệ protein lớn này có khả năng đóng vai trò như các miếng đệm chắp giữa các phiến gian thylakoid stroma.[110]
Số lượng thylakoid và tổng diện tích thylakoid của lục lạp chịu ảnh hưởng bởi sự tiếp nhận ánh sáng. Những lục lạp che dưới bóng râm chứa một lượng grana lớn và nhiều cùng với một diện tích màng phủ thylakoid rộng hơn lục lạp hứng chịu ánh sáng chói lóa. Những thông số này của hệ thống thylakoid có thể thay đổi chỉ trong vài phút tiếp xúc với ánh sáng hoặc không cho tiếp xúc.[95]
Sắc tố và màu sắc lục lạp sửa
Bên trong những quang hệ khảm vào màng thylakoid lục lạp là đa dạng nhiều loại sắc tố quang hợp, chúng có chức năng hấp thụ và thuyên chuyển năng lượng ánh sáng. Những loại sắc tố này được tìm thấy trong nhiều nhóm lục lạp khác nhau, và chúng cùng tạo nên một lượng lớn màu sắc đa dạng cho lục lạp.
Diệp lục (Chlorophyll) sửa
Diệp lục a (hay chlorophyll a) là sắc tố tìm thấy ở tất cả lục lạp, cũng như cả tổ tiên của chúng là vi khuẩn lam. Diệp lục a là một loại sắc tố màu lục lam[114] chịu trách nhiệm cho sự hình thành màu sắc ở hầu hết vi khuẩn lam và lục lạp. Ngoài diệp lục a, còn có thêm một số sắc tố khác thuộc nhóm này, bao gồm: sắc tố phụ diệp lục b, diệp lục c, diệp lục d[16] và diệp lục f.
Diệp lục b là một sắc tố màu xanh ô liu chỉ tìm thấy trong lục lạp thực vật, tảo lục, lục lạp cấp hai nguồn gốc tảo lục và một ít vi khuẩn lam.[16] Hai loại diệp lục là diệp lục a và b đã cùng nhau tạo nên màu xanh cho phần lớn lục lạp thực vật và tảo lục.[114]
Diệp lục c chủ yếu có mặt trong lục lạp cấp hai nguồn gốc tảo đỏ, mặc dù nó không được tìm thấy trong chính lục lạp tảo đỏ. Ngoài ra, diệp lục c còn xuất hiện ở vài loại tảo lục và vi khuẩn lam.[16]
Diệp lục d và f chỉ có ở một số vi khuẩn lam.[16][115]
Carotenoid sửa
Ngoài diệp lục, một nhóm sắc tố vàng cam[114] gọi là carotenoid cũng được tìm thấy trong các quang hệ. Có khoảng 30 loại sắc tố quang hợp carotenoid.[116] Chúng hỗ trợ cho sự vận chuyển và tiêu hủy năng lượng dư thừa;[16] màu sắc tươi sáng của chúng đôi khi cũng chèn lấp đi màu xanh diệp lục, như trong mùa thu, ta có thể bắt gặp những tán xanh bắt đầu đổi dần sang những màu sắc ấm áp hơn, như đỏ, vàng... rồi cuối cùng rụng đi theo những cơn gió.[117] β-carotene là một loại carotenoid đỏ vàng có mặt hầu như trong tất cả lục lạp, y như chlorophyll a.[16] Bên cạnh đó, xanthophyll, đặc biệt là loại zeaxanthin đỏ cam, cũng là một nhóm sắc tố carotenoid phổ biến.[116] Nhiều cấu dạng khác của carotenoid vẫn còn hiện hữu, nhưng chỉ tìm thấy trong một số nhóm lục lạp nhất định.[16]
Phycobilin sửa
Phycobilin là nhóm sắc tố thứ ba tìm thấy trong vi khuẩn lam, lục lạp tảo lục lam, tảo đỏ và tảo cryptophyte.[16][118] Phycobilin có ở mọi màu, trong đó, có loại phycoerytherin là một trong những sắc tố khiến tảo đỏ có màu đỏ đặc trưng.[119] Phycobilin thường tổ chức thành các phức hệ protein tương đối lớn, đường kính khoảng 40 nanomet gọi là phycobilisome.[16] Giống như quang hệ I và ATP synthase, phycobilisome cũng định vị ở những vị trí tiếp xúc với chất nền stroma, ở tảo đỏ chúng còn khiến cho các thylakoid không thể xếp chồng.[16] Lục lạp cryptophyte và vài vi khuẩn lam không tổ chức các sắc tố phycobilin của chúng trong các phycobilisome, mà thay vào đó là giữ nó trôi nổi trong xoang thylakoid.[16]
Lục lạp chuyên hóa ở thực vật C4 sửa
Để cố định carbon dioxide thành chất đường trong quá trình quang hợp, lục lạp sử dụng một enzyme gọi là rubisco. Nhưng có một vấn đề quan trọng với rubisco là nó không thể phân biệt được carbon dioxide (CO2) và oxy (O2), vì vậy trong điều kiện nồng độ oxy cao, rubisco vô tình cố định thêm oxy vào tiền chất chất đường. Hậu quả là gây lãng phí năng lượng ATP và thải ra CO2 thay vì O2, làm giảm hiệu quả sản xuất bột đường. Đây là một vấn đề nghiêm trọng, bởi O2 là sản phẩm ban đầu của phản ứng sáng trong quá trình quang hợp, nên điều này sẽ ảnh hưởng đến tính toàn vẹn của chu trình Calvin sau đó nếu sử dụng rubisco.[120]
Thực vật C4 đã phát triển một cách để giải quyết vấn đề này, chính là tách rời không gian xảy ra phản ứng sáng và chu trình Calvin, không cho cả hai diễn ra trong cùng một lục lạp. Phản ứng sáng (pha sáng), quá trình hấp thụ năng lượng ánh sáng và truyền tải năng lượng đó cho ATP và NADPH, hoàn toàn thực hiện bởi các tế bào thịt lá của lá cây C4. Chu trình Calvin (pha tối), chu trình tổng hợp bột đường với sự hỗ trợ từ năng lượng của phản ứng sáng và chất nhận rubisco, hoàn toàn thực hiện bởi các tế bào bao bó mạch, bố trí tỏa tròn xung quanh gân lá.[120]
Kết quả, lục lạp (tế bào) thịt lá C4 và tế bào bao bó mạch trở thành những lục lạp chuyên hóa, đảm nhận từng công đoạn chuyên biệt trong quá trình quang hợp. Ở tế bào thịt lá, lục lạp chỉ đảm đương pha sáng, do đó chúng vẫn có một hệ thống thylakoid và grana bình thường,[105] sử dụng để tạo nên ATP và NADPH, giải phóng khí oxy; đồng thời chúng cũng mất đi enzyme rubisco do không thực hiện chu trình Calvin. Những lục lạp này lưu trữ CO2 trong một hợp chất bốn carbon, đó là lý do của cái tên C4, đầy đủ: quá trình quang hợp C4. Tiếp theo, hợp chất bốn carbon này sẽ di chuyển đến lục lạp (tế bào) bao bó mạch, gửi lại CO2 và trở về tế bào thịt lá. Lục lạp bao bó mạch không đảm nhận phản ứng sáng, đồng thời ngăn chặn khí oxy vào trong làm gián đoạn hoạt động của rubisco.[120] Vì vậy, thylakoid của chúng không còn xếp chồng thành grana mà tự do trôi nổi trong chất nền stroma, có vai trò thực hiện chuỗi chuyền điện tử, chuyển hóa năng lượng ánh sáng thành hoạt chất cao năng ATP hỗ trợ hoạt động cho chu trình Calvin mà không sản sinh oxy. Chúng thiếu đi phức hệ quang hệ II và chỉ có quang hệ I—loại quang hệ cần thiết duy nhất cho chuỗi chuyền điện tử.[105][120] Do hoạt động của lục lạp bao bó mạch chỉ gói gọn trong chu trình Calvin và hóa đường, nên chúng thường chứa đựng những hạt tinh bột lớn.[105]
Cả hai dạng lục lạp trên đều có một mạng lưới ngoại vi rộng lớn,[105] nhằm mục đích tăng cường diện tích bề mặt, hỗ trợ tốt hơn sự lưu thông vật chất giữa các lục lạp.[94][95] Mạng lưới ngoại vi của lục lạp thịt lá nhỏ hơn chút ít so với lục lạp bao bó mạch.[121]
Phân bố sửa
Phân bố trong cây sửa
Không phải toàn bộ tế bào thực vật đa bào đều chứa lục lạp. Chỉ có những phần màu xanh của một cái cây mới là khu vực phân bố bào quan lục lạp, đó là những nơi mà sắc tố diệp lục của lục lạp bao phủ, có khả năng quang hợp.[15] Các tế bào thực vật chứa lục lạp thường là các tế bào nhu mô (mô mềm, parenchyma tissue), mặc dù lục lạp cũng có mặt trong giao mô (mô dày, collenchyma tissue).[122] Những tế bào nhu mô chứa lục lạp còn gọi là tế bào lục mô (mô thịt lá, mô diệp nhục, chlorenchyma tissue). Một tế bào lục mô điển hình của thực vật đất liền chứa khoảng 10–100 lục lạp.
Trong một số loại cây như xương rồng, lục lạp tìm thấy trong thân[123] thay vì tập trung tại lá. Mỗi milimet vuông mô lá có thể chứa đến nửa triệu lục lạp.[15] Trong lá, lục lạp chủ yếu có mặt trong các lớp diệp nhục và tế bào bảo vệ khí khổng. Tế bào mô giậu (lục mô hàng rào) có khả năng chứa đến 30–70 lục lạp trên mỗi tế bào, trong khi các tế bào bảo vệ khí khổng lại chỉ có 8–15 lục lạp trên mỗi tế bào, và cũng chứa ít diệp lục hơn. Lục lạp cũng có thể tìm thấy trong các tế bào bao bó mạch; đặc biệt ở thực vật C4, những tế bào này chính là nơi thực hiện chu trình Calvin. Trong các lớp biểu bì lá, lục lạp hiếm khi xuất hiện.[124]
Phân bố trong tế bào sửa
Sự vận động của lục lạp sửa
Lục lạp tế bào thực vật và tảo có khả năng tự định hướng phân bố phù hợp tùy theo điều kiện chiếu sáng. Trong tình trạng ánh sáng yếu, chúng tập trung thành những mảng song song mặt đáy nhằm tối đa hóa diện tích bề mặt hấp thụ. Còn trong điều kiện ánh sáng mãnh liệt, chúng tìm kiếm những vị trí trú ẩn bằng cách sắp xếp dọc theo các cạnh lồi của thành tế bào hoặc chuyển sang những phía có thể đảm bảo lợi thế chiếu sáng. Việc này giúp lục lạp giảm thiểu sự phơi sáng và phòng ngừa tình trạng tổn hại quang oxy hóa (photooxidative damage).[125] Khả năng phân bố lục lạp bằng cách trú ẩn hay trải thành những mảng có thể là lý do mà thực vật đất liền tiến hóa hơn trong việc có nhiều lục lạp nhỏ thay vì chỉ vỏn vẹn vài cái lớn.[126] Sự vận động của lục lạp được cho là một trong những hệ kích thích–đáp ứng chặt chẽ nhất thực vật.[127] Người ta cũng từng quan sát thấy ty thể theo đuôi lục lạp khi lục lạp di chuyển.[128]
Ở thực vật bậc cao, sự vận động của lục lạp điều hành bởi các phototropin, loại protein thụ quang ánh sánh xanh dương, đồng thời cũng là protein chịu trách nhiệm cho tính hướng sáng (quang hướng động) ở thực vật. Trong một số loài tảo, rêu, dương xỉ và thực vật có hoa, sự vận động của lục lạp còn chịu ảnh hưởng của ánh sáng đỏ bên cạnh ánh sáng xanh dương,[125] trong đó những ánh sáng đỏ xa với bước sóng siêu dài lại ức chế chuyển động thay vì tăng cường. Ánh sáng xanh dương đa phần khiến lục lạp tránh xa tìm nơi trú ẩn, trong khi ánh sáng đỏ lại hấp dẫn chúng, điều này giúp tối ưu hóa hiệu quả hấp thụ ánh sáng.[128]
Những nghiên cứu về Vallisneria gigantea, một loài thủy sinh có hoa thuộc chi Tóc tiên nước (Vallisneria), đã chỉ ra rằng lục lạp có thể di chuyển chỉ sau năm phút tiếp xúc với ánh sáng, mặc dù chúng không thực sự định hướng phân bố ngay từ đầu. Có khả năng những lục lạp này đã bám vào hệ vi sợi để di chuyển, và thực tế cho thấy mạng lưới vi sợi cũng tự thay đổi hình dạng thành một cấu trúc tổ ong xung quanh lục lạp khi lục lạp chuyển động, điều này gợi ý những vi sợi có thể đã neo giữ lục lạp đến những vị trí phù hợp.[127][128]
Chức năng và thành phần hóa học sửa
Lục lạp tế bào bảo vệ sửa
Không như hầu hết tế bào biểu bì, các tế bào bảo vệ khí khổng chứa một lượng tương đối lục lạp phát triển tốt.[124] Tuy nhiên, những gì chính xác ẩn sau đó vẫn còn trong vòng tranh cãi.[129]
Miễn dịch tự nhiên ở thực vật sửa
Thực vật thiếu đi những tế bào miễn dịch thực thụ, vì vậy mà toàn bộ tế bào trong cơ thể thực vật đều tham gia các đáp ứng miễn dịch. Lục lạp, cùng với nhân tế bào, màng tế bào và lưới nội chất,[130] là những thành phần chủ chốt ngăn ngừa mầm bệnh. Do có vai trò trong hệ thống miễn dịch tế bào thực vật, lục lạp thường xuyên là đích ngắm của những tác nhân gây bệnh.[130]
Thực vật có hai hệ thống đáp ứng miễn dịch chính: đáp ứng siêu nhạy (đáp ứng HR—hypersensitive response), là sự kiện các tế bào nhiễm bệnh tự động niêm phong và trải qua cái chết theo chương trình, và hệ thống miễn dịch thu được (đáp ứng SAR—systemic acquired resistance), có thể phát đi những tín hiệu cảnh báo từ nơi các tế bào nhiễm bệnh đến phần cơ thể còn lại về mối nguy hiện diện của mầm bệnh. Lục lạp khởi động cả hai hệ thống đáp ứng này bằng cách cố ý làm hỏng chức năng quang hợp, sản xuất những chủng chất hoạt động có oxy (reactive oxygen species), gồm hai nhóm: gốc oxy tự do và tiền chất gốc oxy tự do.[131] Sự tăng sinh đẩy cao nồng độ những chất này sẽ gây ra hàng loạt đáp ứng siêu nhạy. Đồng thời, những chủng chất hoạt động có oxy cũng trực tiếp giết chết bất cứ tác nhân gây bệnh nào bên trong tế bào. Những nồng độ thấp hơn của nhóm chất này giúp khởi động hệ thống miễn dịch thu được, kích hoạt các phân tử bảo vệ trong những phần cơ thể còn lại.[130]
Được biết ở vài loài thực vật, lục lạp còn di chuyển đến gần những khu vực lây nhiễm và nhân tế bào trong suốt thời gian nhiễm bệnh.[130]
Lục lạp có thể đảm nhận công việc của một cảm biến cho tế bào. Khi phát hiện stress trong tế bào, mà có khả năng gây ra bởi một tác nhân gây bệnh, lục lạp bắt đầu sản xuất các phân tử như acid salicylic, acid jasmonic, oxide nitric và cả chủng chất hoạt động có oxy nhằm tiến hành nhiệm vụ kháng bệnh lẫn truyền tin. Tựa như những tín hiệu tế bào, những chủng chất hoạt động có oxy là những phân tử hóa học không ổn định, vì vậy chúng có thể không rời khỏi lục lạp, mà thay vào đó là truyền lại tín hiệu của chúng cho một loại phân tử lan truyền chưa thể biết rõ. Tất cả những phân tử này đều phát đi các tín hiệu ngược dòng (retrograde signaling)—loại tín hiệu xuất phát từ lục lạp có khả năng điều hòa biểu hiện gen trong nhân.[130]
Ngoài cơ chế miễn dịch bằng tín hiệu, lục lạp, với sự giúp đỡ của bào quan peroxisome,[132] có thể tổng hợp nên một phân tử bảo vệ quan trọng, là jasmonate (một loại acid béo oxy hóa đóng vai trò đặc biệt trong sự sinh trưởng, quang hợp và chống chịu ở thực vật). Trong tế bào thực vật, lục lạp tổng hợp tất cả các loại acid béo,[130][133] trong đó có acid linoleic, tiền chất của jasmonate.[130]
Quang hợp sửa
Một trong những chức năng chính của lục lạp là quang hợp, đây là quá trình biến đối năng lượng ánh sáng thành năng lượng hóa học, và dùng nó để sản xuất ra những chất đường. Nước (H2O) và carbon dioxide (CO2) là những chất tham gia quang hợp, còn đường và khí oxy (O2) là những sản phẩm giải phóng nhờ vào nguồn năng lượng ánh sáng. Quang hợp gồm hai giai đoạn: phản ứng sáng (pha sáng), giai đoạn mà nước bị phân li bài xuất ra oxy, và phản ứng tối (pha tối) hay chu trình Calvin, giai đoạn tổng hợp chất đường từ carbon dioxide. Hai pha này kết nối với nhau thông qua những chất mang năng lượng là adenosine triphosphate (ATP) và nicotinamide adenine dinucleotide phosphate (NADP+).[134][135]
Phản ứng sáng sửa
Phản ứng sáng diễn ra trên màng thylakoid. Chúng hấp thụ năng lượng ánh sáng và lưu giữ nó trong NADPH, dạng khử của NADP+, và ATP, cung cấp năng lượng cho hoạt động của phản ứng tối.
Chất mang năng lượng sửa
ATP là dạng phosphoryl hóa của adenosine diphosphate (ADP), có vai trò lưu trữ và cung cấp năng lượng cho hầu hết các hoạt động của tế bào. ATP là hoạt chất cao năng tràn đầy năng lượng, còn ADP là tiền chất của ATP. NADP+ là chất mang điện tử (electron), chuyên chở những electron cao năng lượng. Trong phản ứng sáng, nó bị khử, nghĩa là lấy thêm những electron mới, trở thành NADPH.
Quá trình quang phosphoryl hóa sửa
Giống như ty thể, lục lạp sử dụng thế năng dự trữ trong gradient ion H+ (ion hydro) để sản sinh năng lượng ATP. Ban đầu, hai quang hệ hấp thụ năng lượng ánh sáng nhằm kích thích các electron phân li từ nước và chuyển chúng đến chuỗi chuyền điện tử. Những phức hệ giữa hai quang hệ sử dụng năng lượng từ các electron kích hoạt để bơm ion H+ vào xoang thylakoid, xác lập nên một gradient, với tương quan lượng ion H+ trong hệ thống thylakoid nhiều hơn hàng nghìn lần so với chất nền.[86] Tiếp theo, những ion H+ trong xoang thylakoid khuếch tán trở lại stroma theo chiều chênh lệch gradient nồng độ thông qua ATP synthase. ATP synthase lợi dụng thế năng từ dòng chảy ion H+ trở ngược để khai thác năng lượng và tiến hành phosphoryl hóa adenosine diphosphate (ADP) thành adenosine triphosphate (ATP).[86][136] Trong lục lạp, phần "núm xoay" (rotor) của ATP synthase nằm trong chất nền nên ATP cũng được tổng hợp tại đây, chuẩn bị tiêu thụ cho những phản ứng pha tối.[137]
Sự khử NADP+ sửa
Những electron mất tích trong chuỗi chuyền điện tử thường đã chuyển đến NADP+, khử nó trở thành NADPH. Giống như ATP synthase, ferredoxin-NADP+ reductase, enzyme khử NADP+, cũng thải loại NADPH vào chất nền, cùng với ATP cung cấp năng lượng cho các phản ứng tối.[137]
Bởi vì sự khử NADP+ liên tục lấy đi những electron từ chuỗi chuyền điện tử, nên lượng electron này phải luôn được bổ sung. Đây chính là vai trò của quang hệ II, nơi phân li nước (H2O) cung cấp thường xuyên electron cho pha sáng.[86][134]
Con đường quang phosphoryl hóa vòng sửa
Trong khi quang hệ II quang phân li nước sản sinh và kích thích các electron, quang hệ I chỉ đơn giản khai thác triệt để năng lượng này bằng cách tái kích hoạt các electron còn sót lại ở cuối mỗi chuỗi chuyền điện tử. Thông thường, những electron tái sinh sẽ chuyển đến tiêu thụ bởi NADP+, mặc dù đôi khi chúng cũng có thể trở ngược cung cấp năng lượng cho các phức hệ protein chuyển vận để bơm thêm nhiều ion H+ vào xoang thylakoid nhằm sản xuất bổ sung ATP. Tiến trình này được gọi là con đường quang phosphoryl hóa vòng, do có sự tái sử dụng những electron. Con đường quang phosphoryl hóa vòng phổ biến ở thực vật C4—những loài có nhu cầu ATP nhiều hơn NADPH.[120]
Phản ứng tối sửa
Chu trình Calvin, còn gọi là pha tối, phản ứng tối hay chính xác nhất là phản ứng không phụ thuộc ánh sáng, là một quy trình tuần hoàn gồm hàng loạt phản ứng hóa sinh nhằm mục đích cố định CO2 hình thành phân tử đường G3P, sử dụng năng lượng và electron cung cấp từ ATP và NADPH của pha sáng. Chu trình Calvin diễn ra trong chất nền lục lạp.[120]
Dù gán tên là "phản ứng tối", nhưng trong phần lớn thực vật, quá trình này đều diễn trong ánh sáng, vì hoạt động của chúng phụ thuộc vào các sản phẩm của phản ứng sáng.[15]
Cố định carbon và tổng hợp G3P sửa
Chu trình Calvin khởi động từ sự kiện enzyme rubisco cố định CO2 vào hợp chất năm carbon ribulose-1,5-bisphosphate (RuBP). Kết quả là hình thành một hợp chất sáu carbon không ổn định và ngay lập tức phân hủy thành các phân tử ba carbon gọi là acid 3-phosphoglyceric, hay 3-PGA. ATP và NADPH từ phản ứng sáng sẽ chuyển hóa 3-PGA thành glyceraldehyde-3-phosphate, hay đường G3P. Hầu hết các phân tử G3P được tái sinh trở lại chất nhận RuBP sử dụng năng lượng ATP, nhưng cứ sản xuất nên sáu phân tử này thì một trong số chúng (sản phẩm cuối cùng của phản ứng tối) lại thoát khỏi chu trình để đi đến các quá trình hình thành carbohydrate bậc cao hơn.[120]
Đường và tinh bột sửa
Glyceraldehyde-3-phosphate có thể kết đôi với nhau để tạo nên những phân tử đường lớn hơn như glucose và fructose. Những phân tử này tiếp tục hóa hợp lại và hình thành nên đường disaccharide sucrose (hay đường cát). Toàn bộ quá trình đây đều diễn ra bên ngoài lục lạp, trong tế bào chất.[138]
Bên cạnh đó, các đơn phân glucose trong lục lạp có thể liên kết với nhau tạo nên tinh bột, tích lũy thành những hạt tinh bột trôi nổi trong chất nền stroma.[138] Dưới điều kiện nồng độ CO2 khí quyển cao, các hạt tinh bột có thể phát triển rất lớn, gây biến dạng grana và thylakoid. Dẫn đến các hạt tinh bột thay thế luôn cả hệ thống thylakoid, nhưng vẫn bảo tồn thylakoid nguyên vẹn bên trong.[139] Trong những cây úng nước, có thể xảy ra sự tích tụ tinh bột ngay trong lục lạp, có lẽ do ít sucrose bài xuất ra khỏi lục lạp (hay chính xác hơn là ra khỏi tế bào thực vật). Vấn đề này làm cạn kiệt nguồn chu cấp những gốc phosphate tự do, những gốc gián tiếp tham gia tổng hợp tinh bột ở lục lạp.[139] Mặc dù có liên quan đến tỉ lệ quang hợp thấp, nhưng những hạt tinh bột lại không nhất thiết có mặt trong việc can thiệp đáng kể đến hiệu suất quang hợp,[140] và có khả năng đơn giản chỉ là ảnh hưởng phụ của một yếu tố suy giảm quang hợp khác (photosynthesis-depressing factor).[139]
Hô hấp sáng sửa
Hô hấp sáng có thể xảy ra khi nồng độ oxy đạt ngưỡng quá cao. Khiến enzyme rubisco không thể phân biệt hiệu quả oxy và carbon dioxide, vô tình cố định thêm O2 thay vì CO2 vào RuBP. Quá trình này gây giảm hiệu suất quang hợp: tiêu thụ ATP, thải CO2 và không sản xuất đường. Hô hấp sáng có thể lãng phí đến tận một nửa lượng carbon cố định bởi chu trình Calvin.[134] Một số cơ chế tiến hóa hơn đã phát triển để giải quyết vấn đề này, bằng cách nâng cao nồng độ CO2 tương ứng với nồng độ O2 trong lục lạp, tăng hiệu quả quang hợp. Chúng được gọi chung là cơ chế tập trung carbon dioxide (carbon dioxide concentrating mechanism hay CCM). Trong đó gồm có con đường chuyển hóa acid kiểu Thuốc bỏng (Crassulacean acid metabolism hay CAM), con đường cố định carbon C4,[134] và pyrenoid. Đáng chú ý ở thực vật C4, lục lạp của chúng chuyên hóa thành hai dạng có chức năng khác biệt.
Độ pH sửa
Do luôn có một gradient H+ thẩm thấm qua lớp màng thylakoid, nên chất nguyên sinh trong xoang thylakoid có tính acid, với pH dao động quanh 4.[141] Trong khi đó, chất nền stroma tương đối trung tính, với pH dao động quanh 8.[142] pH stroma tối ưu cho chu trình Calvin là 8,1, và sụt xuống 7,3 khi xảy ra những phản ứng cuối chu trình.[143]
CO2 lẫn trong nước có thể tạo nên acid carbonic, ảnh hưởng đến pH của những lục lạp cô lập, gây trở ngại quang hợp, dù cho CO2 là nguyên liệu của quang hợp. Nhưng trong thực tế, lục lạp tế bào thực vật không chịu ảnh hưởng đáng kể bởi vấn đề này.[142]
Lục lạp có khả năng bơm ion K+ và H+ lưu thông vào ra bằng cách sử dụng một hệ thống vận chuyển định hướng ánh sáng chưa thể hiểu rõ.[142]
Khi có ánh sáng, pH xoang thylakoid có thể giảm đến 1,5 đơn vị, trong khi pH stroma lại tăng lên gần 1 đơn vị.[143]
Tổng hợp amino acid sửa
Lục lạp là bào quan duy nhất tổng hợp phần lớn những amino acid của tế bào thực vật trong chất nền stroma,[144] ngoại trừ những amino acid chứa lưu huỳnh như cysteine và methionine.[145][146] Cysteine có thể tạo bởi lục lạp (và tiền lạp thể) nhưng nó cũng được tổng hợp trong bào tương và ty thể, có lẽ do nó gặp rắc rối trong việc chuyển vận qua màng để đi đến những nơi cần thiết.[146] Lục lạp cũng tạo nên tiền chất của methionine, nhưng không rõ liệu lục lạp có đảm nhận luôn chặng cuối của tiến trình tổng hợp này hay không, hoặc có khả năng chuyển sang bào tương để hoàn thành.[147]
Những hợp chất nitơ khác sửa
Lục lạp tổng hợp tất cả purine và pyrimidine cho tế bào, đây là những đơn phân base nitơ hóa hợp nên DNA và RNA.[144] Đồng thời, lục lạp cũng chuyển hóa nhóm nitrit (NO2−) thành amonia (NH3) cung cấp nitơ cho những cơ chế tổng hợp amino acid và nucleotide.[144]
Những sản phẩm hóa học khác sửa
Lục lạp là nơi xảy ra quá trình chuyển hóa lipid phức tạp.[148]
Hàm lượng các chất hóa học trong lục lạp sửa
| Chất | Hàm lượng (%) | Các cấu thành |
|---|---|---|
| Protein | 30–55% | Khoảng 80% protein không hòa tan, tham gia cấu tạo nên các lớp màng cùng với lipid, còn lại 20% tan dưới dạng các enzyme. |
| Lipid | 20–30% | 50% chất béo, 20% sterol, 16% sáp và 7–20% phospholipid. Không có cholesterol. |
| Chlorophyll (a + b) | 9% | 75% chlorophyll a và 25% chlorophyll b. |
| Carotenoid | 4,5% | 25% carotene và 75% xanthophyll. |
| RNA | 3–7% | |
| DNA | 0,5% | |
| Cytochrome f | 0,1% | |
| Vitamin K | 0,004% | |
| Vitamin E | 0,08% | |
| Các chất khoáng | dạng vết | Mg, Fe, Cu, Mn, Zn và P. |
Phân loại, phân đôi, và di truyền sửa
Lục lạp (chloroplast) là một loại đặc biệt của một nhóm bào quan trong tế bào thực vật gọi là lạp thể (plastid), mặc dù cũng có lúc hai thuật ngữ này được dùng thay thế lẫn nhau. Có rất nhiều loại lạp thể khác nhau, tham gia nhiều chức năng đa dạng. Tất cả lục lạp trong cơ thể thực vật đều có nguồn gốc từ những tiền lạp thể (proplastid) chưa phân hóa, có trong hợp tử[144] hay trứng đã thụ tinh. Tiền lạp thể thường tìm thấy tại những đỉnh sinh trưởng của thực vật trưởng thành. Nhưng trong mô phân sinh đỉnh rễ,[150] lục lạp không phát triển bình thường từ tiền lạp thể, mà phần lớn phân hóa thành lạp bột (amyloplast) chuyên dự trữ tinh bột.[144]
Ở chồi ngọn, tiền lạp thể trong mô phân sinh đỉnh chồi có thể dần dần phân hóa thành lục lạp trong các mô lá quang hợp như lá trưởng thành, nếu được tiếp xúc với một lượng ánh sáng cần thiết.[13] Quá trình biệt hóa này liên quan đến sự lõm vào của màng trong lạp thể, hình thành nên những phiến màng lấn sâu vào chất nền stroma. Rồi sau đó gấp cuộn trở lại tạo thành hệ thống thylakoid và grana.[151]
Nếu như chồi cây hạt kín không được tiếp xúc một lượng ánh sáng cần thiết cho sự hình thành lục lạp, thì tiền lạp thể có thể phân hóa thành dạng tiền lục lạp trước khi trở thành lục lạp. Tiền lục lạp (etioplast) là loại lạp thể thiếu chất diệp lục và có màng trong lõm vào tạo nên một mạng lưới các ống trôi nổi trong stroma, gọi là thể tiền phiến (prolamellar body). Dù tiền lục lạp thiếu chất diệp lục, nhưng chúng vẫn sở hữu một loại tiền chất diệp lục màu vàng dưới dạng dự trữ.[13] Trong vòng vài phút phơi sáng, những thể tiền phiến bắt đầu tổ chức thành những chồng xấp thylakoid, và diệp lục cũng được khởi động sản xuất. Quá trình chuyển hóa từ tiền lục lạp thành lục lạp này có thể kéo dài đến hàng giờ.[151] Trong khi đó, thực vật hạt trần lại không cần ánh sáng để hình thành lục lạp.[151]
Không thể đảm bảo rằng dưới tác dụng của ánh sáng, tiền lạp thể luôn luôn phân hóa trở thành lục lạp. Dù cho tiền lạp thể có phát triển thành lục lạp đi chăng nữa thì một số loại lạp thể khác vẫn chịu sự kiểm soát chủ yếu của nhân tế bào,[13] cũng như ảnh hưởng nhiều từ loại tế bào đặc trưng chứa chúng.[144]
Sự chuyển hóa lạp thể sửa
Sự phân loại lạp thể không mang tính ổn định, trên thực tế có thể xảy ra nhiều con đường chuyển hóa lạp thể qua lại với nhau. Lục lạp có thể chuyển đổi sang sắc lạp (chromoplast), chứa đầy bên trong những phân tử sắc tố tạo nên màu sắc tươi sáng cho hoa và quả chín. Lạp bột (amyloplast) dự trữ tinh bột có thể chuyển hóa sang sắc lạp, và những tiền lạp thể cũng có khả năng tương tự. Sắc lạp và lạp bột lại có thể trở ngược về lục lạp, giống như khi chiếu sáng một củ cà rốt hay khoai tây. Nếu cây tổn thương, hoặc gặp vấn đề khiến tế bào thực vật trở về trạng thái mô phân sinh, thì lục lạp và những lạp thể khác có thể chuyển hóa ngược lại thành tiền lạp thể. Lục lạp, lạp bột, sắc lạp, tiền lạp thể... là sự phân loại không tuyệt đối—trên thực tế những dạng trung gian giữa chúng phổ biến hơn nhiều.[144]
Quá trình phân đôi lục lạp sửa
Hầu hết lục lạp trong tế bào có khả năng quang hợp đều không phát triển trực tiếp từ tiền lạp thể hay tiền lục lạp. Sự thực, một tế bào mô phân sinh đỉnh chồi điển hình ở thực vật chỉ chứa 7–20 tiền lạp thể. Khi tiền lạp thể biệt hóa xong thành lục lạp, chúng tiếp tục phân chia tạo đến 30–70 lục lạp đối với một tế bào quang hợp thực vật trưởng thành. Nếu tế bào xảy ra phân bào, lục lạp cũng phân đôi để cung cấp những lục lạp bổ sung cho hai tế bào con.[152]
Trong tảo đơn bào, quá trình phân đôi là cách duy nhất để sản sinh lục lạp. Chúng không có những tiền lạp thể, vì vậy khi tế bào tảo phân bào, lục lạp cũng phân đôi song hành, và mỗi tế bào con sau đó đều nhận được một lục lạp trưởng thành.[151]
Phần lớn lục lạp trong tế bào đều phân đôi, chứ không phải chỉ có một nhóm nhỏ lục lạp có khả năng phân đôi nhanh chóng.[153] Lục lạp không có pha S rõ ràng, do quá trình nhân đôi DNA của chúng không đồng bộ hay chịu sự kiểm soát của tế bào chủ.[154] Phần nhiều những hiểu biết hiện nay của chúng ta về quá trình phân đôi lục lạp đến từ việc nghiên cứu những sinh vật như cải Arabidopsis và tảo đỏ Cyanidioschyzon merolæ.[126]
Quá trình phân đôi khởi động khi các protein FtsZ1 và FtsZ2 lắp rắp thành những bó sợi, cùng với sự giúp đỡ của protein ARC6, tạo nên một cấu trúc gọi là đai Z (Z-ring) bên trong stroma lục lạp.[126][155] Hệ thống Min có vai trò hoạch định vị trí đai Z, đảm bảo rằng lục lạp được thắt vừa đủ dù nhiều hay ít. Trong đó, protein MinD ức chế FtsZ liên kết và hình thành sợi. Các protein ARC3 cũng có thể tham gia, nhưng chưa có thông tin rõ ràng về chúng. Những protein này hoạt động tại hai đầu cực lục lạp, ngăn ngừa hình thành đai Z tại đó, nhưng càng đến gần vị trí trung tâm lục lạp, MinE lại ức chế chúng, cho phép đai Z tạo thành.[126]
Tiếp theo, hai đai phân đôi hay đai PD (plastid-dividing ring) hình thành. Đai phân đôi trong đặt ở phía trong màng trong lục lạp, và xuất hiện đầu tiên.[126] Còn đai phân đôi ngoài quấn quanh màng ngoài lục lạp. Chúng cấu tạo từ những sợi đường kính khoảng 5 nanomet,[126] xếp lại thành bó gồm các chuỗi cách nhau 6,4 nanomet và có tác dụng co thắt lục lạp. Chuỗi sự kiện này báo hiệu bắt đầu tiến trình thắt lại lục lạp.[155] Ở vài loài như tảo Cyanidioschyzon merolæ, lục lạp có thêm một đai phân đôi thứ ba đặt trong xoang gian màng.[126][155]
Khi đến pha thắt lục lạp, protein dynamin lắp ráp bao quanh đai phân đôi ngoài tạo nên đai dynamin,[155] cung cấp lực thắt siết chặt lục lạp.[126] Bên cạnh đó, đai Z và đai phân đôi trong cũng bị phá hủy.[155] Trong suốt giai đoạn này, nhiều plasmid DNA lục lạp nhân đôi và phân phối cho hai lục lạp con.[156]
Cuối cùng, đai dynamin dịch chuyển xuống dưới đai phân đôi ngoài, tiếp xúc trực tiếp với màng ngoài lục lạp,[155] thắt chặt và tách đôi thành hai lục lạp con.[126]
Phần sót lại của đai phân đôi ngoài trôi nổi tự do, còn phần sót lại của đai dynamin vẫn đính với một trong hai lục lạp con.[155]
Trong số năm hoặc sáu đai liên quan đến quá trình phân đôi lục lạp, chỉ có đai phân đôi ngoài là tham gia xuyên suốt hai pha co thắt và phân đôi—tuy đai Z tạo thành đầu tiên, nhưng sự thắt vẫn chưa xuất hiện cho đến khi hình thành đai phân đôi ngoài.[155]
Sự điều hòa phân đôi sửa
Ở những loài tảo chỉ chứa duy nhất một lục lạp, sự điều hòa của quá trình phân đôi lục lạp là cực kỳ quan trọng để đảm bảo rằng mỗi tế bào con đều nhận được một lục lạp, vì chúng không thể tự tạo ra loại bào quan này.[64][126] Ở những thực vật mà tế bào chứa nhiều lục lạp, sự điều hòa trở nên lỏng lẻo và ít quan trọng hơn. Có khả năng là quá trình phân đôi lục lạp và quá trình phân chia tế bào có phần đồng bộ với nhau, thế nhưng phần lớn các cơ chế liên quan vẫn chưa thể xác định.[126]
Ánh sáng được chứng minh là cần thiết cho quá trình phân đôi lục lạp. Lục lạp có thể sinh trưởng và tiến hành một số hoạt động co thắt dưới ánh sáng xanh lục, nhưng lại trễ nải trong việc hoàn thành nốt quá trình phân đôi với loại ánh sáng chất lượng kém này—vì vậy chúng cần tiếp xúc với ánh sáng trắng để hoàn thành phân đôi nhanh hơn. Quan sát lá rau bina trồng dưới ánh sáng xanh lục cho thấy có nhiều lục lạp lớn dạng quả tạ. Còn khi trồng dưới ánh sáng trắng lại kích thích lục lạp phân đôi nhiều hơn và giảm thiểu dần dạng quả tạ.[153][156]
Di truyền lục lạp sửa
Giống như ty thể, lục lạp thường thừa hưởng vật chất di truyền đơn nguồn từ một lục lạp trước đó. Còn vật chất di truyền lưỡng nguồn—kế thừa từ bộ gen lạp thể của cả cây mẹ và cây bố—xảy ra ở mức rất thấp trong một số thực vật có hoa.[157]
Có nhiều cơ chế ngăn chặn sự di truyền DNA lục lạp theo kiểu lưỡng nguồn, bao gồm quá trình tiêu hủy có chọn lọc lục lạp hay gen của chúng trong giao tử hay hợp tử, kết quả là lục lạp từ một bên bố hoặc mẹ sẽ loại đi khỏi phôi. Những lục lạp từ bố mẹ được phân phối sao cho ở mỗi tế bào hậu duệ đều chỉ chứa một loại lục lạp duy nhất (di truyền đơn nguồn).[158]
Thực vật hạt trần, như cây thông, hầu hết đều chứa lục lạp nguồn gốc từ bố,[159] trong khi thực vật có hoa lại thường thừa kế lục lạp nguồn gốc từ mẹ.[160][161] Lúc trước, người ta cho rằng thực vật có hoa chỉ di truyền loại lục lạp nguồn gốc từ mẹ. Tuy nhiên, hiện nay có nhiều nghiên cứu cho thấy một số trường hợp cũng thừa kế lục lạp nguồn gốc từ bố.[157]
Thực vật hạt kín (thực vật có hoa) có nhiều cách để ngăn ngừa di truyền lục lạp nguồn gốc từ bố. Phần lớn chúng sản xuất ra các tế bào tinh trùng không chứa bất kỳ lạp thể nào. Đồng thời, nhiều nghiên cứu cũng cho thấy còn nhiều cơ chế khác ngăn chặn sự kế thừa lục lạp từ bố trong những thực vật có hoa, chẳng hạn như phân bậc quá trình phân đôi lục lạp thành những mức độ khác nhau trong phôi.[157]
Giữa những loài thực vật hạt kín, lục lạp thừa kế từ bố được phát hiện nhiều hơn loại lục lạp di truyền lưỡng nguồn lai giữa bố và mẹ trong cùng một loài. Điều này gợi ý rằng những gen lai không tương thích có thể gây trở ngại đến các cơ chế ngăn chặn thừa kế từ bố.[157]
Thực vật biến đổi gen lạp thể sửa
Thời gian gần đây, lục lạp đã gây chú ý đến những nhà phát triển cây trồng biến đổi gen. Trong hầu hết thực vật có hoa, lục lạp không được thừa kế từ bố, vì vậy tiến trình trao đổi gen giữa những lạp thể không có sự tham gia phát tán của phấn hoa. Ưu điểm này khiến những lạp thể biến đổi gen là một công cụ đáng giá cho quá trình tạo giống và canh tác những cây trồng biến đổi gen, một lĩnh vực đang bị kìm hãm do tính an toàn sinh học, do đó hạ thấp rủi ro gây ra cho môi trường. Chính sách kìm hãm này vì thế chỉ phù hợp cho sự chung sống giữa nông nghiệp truyền thống và nông nghiệp hữu cơ mà không giải phóng cho thực vật biến đổi gen. Trong khi độ tin cậy của cơ chế đột biến này vẫn chưa được nghiên cứu trong tất cả cây trồng có liên quan, thì những kết quả khảo nghiệm gần đây ở cây thuốc lá đã cho thấy những hứa hẹn mới, cho biết tỷ lệ thất bại trong việc ngăn chặn phát tán gen qua phấn hoa ở thực vật biến đổi gen lạp thể chỉ là 3 trên 1.000.000 mẫu.[161]
So sánh ty thể và lục lạp sửa
Ghi chú: Dữ liệu so sánh dựa trên kiến thức sinh học phổ thông.[162][163]
Giống nhau sửa
- Đều có một lớp màng kép bao quanh.
- Đều có nguồn gốc từ sinh vật nhân sơ theo lý thuyết nội cộng sinh, cho thấy ty thể và lục lạp từng là những vi khuẩn bị hòa hợp theo tiến trình nhập bào với tế bào nhân thực sơ khai.
- Đều sở hữu DNA vòng riêng, mã hóa cho một số enzyme xúc tác các phản ứng hóa học đặc trưng của hai bào quan.
- Đều chứa ribosome 70S, trong đó gồm hai tiểu phần 50S và 30S, phục vụ quá trình dịch mã tổng hợp protein.
- Đều có mặt enzyme ATP synthase, sử dụng năng lượng giải phóng từ dòng chảy proton khuếch tán để thực hiện quá trình phosphoryl hóa ADP thành ATP (vì vậy, thêm một điểm giống nhau nữa là cả hai đều có thể tổng hợp ATP).
- Đều có chuỗi chuyền điện tử nhúng trong màng trong và màng thylakoid của ty thể và lục lạp tương ứng.
- Cả hai bào quan này đều có những chu trình hóa học trong đó chất nhận ban đầu được tái sinh vào cuối chu trình. Trong ty thể, chu trình Krebs xảy ra sau khi oxaloacetate tái sinh ở cuối phản ứng. Trong lục lạp, chu trình Calvin xảy ra sau khi ribulose bisphosphate (RuBP) tái sinh ở cuối phản ứng.
Khác nhau sửa
- Có sự khác biệt rõ ràng về cấu trúc bên trong giữa ty thể và lục lạp. Trong ty thể, màng trong uốn khúc lấn sâu vào chất nền tạo thành các mào. Trong lục lạp, lơ lửng trong chất nền là hệ thống thylakoid với sự hiện diện của những túi dẹp tròn thylakoid grana xếp chồng lên nhau tạo thành grana, cùng với các phiến gian thylakoid stroma giúp kết nối các grana với nhau.
- Ty thể thực hiện quá trình hô hấp tế bào (dị hóa), còn lục lạp thực hiện quá trình quang hợp (đồng hóa). Như vậy, về mặt tổng thể, các phản ứng hóa học xảy ra trong mỗi bào quan là khác nhau và ngược lại nhau.
- Phương trình hô hấp tế bào: C6H12O6 + 6O2 → 6CO2 + 6H2O + Q (năng lượng: ATP + nhiệt)
- Phương trình quang hợp: 6CO2 + 12H2O → C6H12O6 + 6H2O + 6O2 (xúc tác: năng lượng ánh sáng, sắc tố)
- Ty thể được tìm thấy trong tất cả tế bào động vật và thực vật. Còn lục lạp chỉ tìm thấy trong những tế bào xanh ở thực vật, chẳng hạn như các tế bào mô giậu và mô xốp (mô khuyết) của lá. Đây là những tế bào tham gia vào quá trình quang hợp. Còn trong những tế bào khác của thực vật, như tế bào rễ, thì không chứa lục lạp.
- Lục lạp chứa đựng trong mình những sắc tố như chlorophyll a, chlorophyll b và carotenoid. Còn ty thể thì không có bất cứ sắc tố nào.
- Phức hệ ATP synthase ở ty thể và lục lạp được định vị theo những hướng khác nhau. ATP synthase trong ty thể đính ở màng trong, với dòng proton chảy từ xoang gian màng vào chất nền. Còn ATP synthase trong lục lạp đính ở màng thylakoid, với dòng proton chảy từ xoang thylakoid ra lại chất nền.
- Những chất nhận điện tử trong ty thể và lục lạp là khác nhau. Trong khi ty thể có NAD+ và FAD+, lục lạp lại có NADP+.
- Nguồn năng lượng sản sinh nên ATP trong ty thể và lục lạp là khác nhau. Trong ty thể, năng lượng này xuất phát từ quá trình oxy hóa của glucose, nên được gọi là quá trình phosphoryl hóa oxy hóa. Trong lục lạp, năng lượng này đến từ ánh sáng, nên được gọi là quá trình quang phosphoryl hóa.
- Ty thể hoạt động cả ngày lẫn đêm. Còn lục lạp phải có ánh sáng thì chúng mới hoạt động.
- Trong chuỗi chuyền điện tử: Chất nhận điện tử cuối cùng ở ty thể là khí oxy, trong khi đó, ở lục lạp là NADP+.
- Trong ty thể, nguồn gốc của các điện tử nói chung xuất phát từ đường glucose (cũng có thể là những chất khác tùy theo con đường phân giải). Trong lục lạp, nguồn gốc của các điện tử lại đến từ quá trình quang phân li nước xảy ra tại quang hệ II. Nước (H2O) đã bị chia nhỏ để giải phóng 2 proton (H+), 2 electron và một phân tử oxy.
- Ty thể xuất ra carbon dioxide từ các phản ứng khử carbon. Còn lục lạp xuất ra oxy từ quá trình quang phân li nước như đã nói ở trên.
Xem thêm sửa
Chú thích sửa
- ^ Jones D (2003) [1917]. Roach P, Hartmann J, Setter J (biên tập). English Pronouncing Dictionary. Cambridge: Cambridge University Press. ISBN 3-12-539683-2.
- ^ “Chloroplast”. Merriam-Webster Dictionary.
- ^ “How large are chloroplasts?”. Cell Biology By The Number. Ron Milo and Rob Philips. Lưu trữ bản gốc ngày 25 tháng 1 năm 2017. Truy cập ngày 29 tháng 7 năm 2016.
- ^ Harper, Douglas. “chloroplast”. Online Etymology Dictionary.
- ^ von Mohl, H. 1835/1837. Ueber die Vermehrung der Pflanzen-Zellen durch Teilung. Dissert. Tubingen 1835. Flora 1837, [1] Lưu trữ 2016-11-07 tại Wayback Machine.
- ^ Schimper, A.F.W. (1883). “Über die Entwicklung der Chlorophyllkörner und Farbkörper” [About the development of the chlorophyll grains and stains]. Bot. Zeitung (bằng tiếng Đức). 41: 105–14, 121–31, 137–46, 153–62. Bản gốc lưu trữ ngày 19 tháng 10 năm 2013. Truy cập ngày 19 tháng 11 năm 2016.
- ^ Strasburger, E. 1884. Das botanische Praktikum, 1. Aufl. Gustav Fischer: Jena
- ^ Gunning, B., Koenig, F. & Govindjee, P. (2006). A dedication to pioneers of research on chloroplast structure. In: R. R. Wise & J. K. Hoober (ed.). The structure and function of plastids. Springer: Netherlands, pp. xxiii-xxxi, [2] Lưu trữ 2016-12-19 tại Wayback Machine.
- ^ Hoober, J. K. (1984). Chloroplasts. Plenum: New York, [3] Lưu trữ 2016-12-19 tại Wayback Machine.
- ^ a b c d e f g h i j Biology 8th Edition Campbell & Reece. Benjamin Cummings (Pearson). 2009. tr. 516.
- ^ Mereschkowsky C (1905). “Über Natur und Ursprung der Chromatophoren im Pflanzenreiche” [About the nature and origin of chromatophores in the vegetable kingdom]. Biol Centralbl (bằng tiếng Đức). 25: 593–604.
- ^ Schimper AFW (1883). “Über die Entwicklung der Chlorophyllkörner und Farbkörper” [About the development of the chlorophyll grains and stains] (PDF). Bot. Zeitung (bằng tiếng Đức). 41: 105–14, 121–31, 137–46, 153–62. Lưu trữ (PDF) bản gốc ngày 12 tháng 10 năm 2016. Truy cập ngày 24 tháng 4 năm 2018.
- ^ a b c d Alberts, Bruce (2002). Molecular biology of the cell (ấn bản 4.). New York [u.a.]: Garland. ISBN 0-8153-4072-9. Lưu trữ bản gốc ngày 14 tháng 11 năm 2020. Truy cập ngày 29 tháng 7 năm 2016.
- ^ a b Kumar, K.; Mella-Herrera, R. A.; Golden, J. W. (2010). “Cyanobacterial Heterocysts”. Cold Spring Harbor Perspectives in Biology. 2 (4): a000315. doi:10.1101/cshperspect.a000315. PMC 2845205. PMID 20452939.
- ^ a b c d e f Biology 8th edition—Campbell&Reece. Benjamin Cummings. 2008. tr. 186–187. ISBN 978-0-321-54325-7.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba Kim, E.; Archibald, J. M. (2009). “Diversity and Evolution of Plastids and Their Genomes”. Trong Sandelius, Anna Stina; Aronsson, Henrik (biên tập). The Chloroplast. Plant Cell Monographs. 13. tr. 1–39. doi:10.1007/978-3-540-68696-5_1. ISBN 978-3-540-68692-7.
- ^ Bryant, Donald A.; Guglielmi, Gérard; Marsac, Nicole Tandeau; Castets, Anne-Marie; Cohen-Bazire, Germaine (1979). “The structure of cyanobacterial phycobilisomes: A model”. Archives of Microbiology. 123 (2): 311–34. doi:10.1007/BF00446810. PMID 10049814.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag Keeling, Patrick J. (2004). “Diversity and evolutionary history of plastids and their hosts”. American Journal of Botany. 91 (10): 1481–93. doi:10.3732/ajb.91.10.1481. PMID 21652304.
- ^ a b c d McFadden, Geoffrey I; Van Dooren, Giel G (2004). “Evolution: Red Algal Genome Affirms a Common Origin of All Plastids”. Current Biology. 14 (13): R514–6. doi:10.1016/j.cub.2004.06.041. PMID 15242632.
- ^ Fuks, Bruno; Fabrice Homblé (ngày 8 tháng 7 năm 1996). “Mechanism of Proton Permeation through Chloroplast Lipid Membranes” (PDF). Plant Physiology. 112 (2): 759–766. doi:10.1104/pp.112.2.759. PMID 8883387. Lưu trữ (PDF) bản gốc ngày 16 tháng 3 năm 2018. Truy cập ngày 25 tháng 8 năm 2013.
- ^ Joyard J Block MA, Douce R; Block; Douce (1991). “Molecular aspects of plastid envelope biochemistry”. Eur J Biochem. 199 (3): 489–509. doi:10.1111/j.1432-1033.1991.tb16148.x. PMID 1868841.
- ^ “Chloroplast”. Encyclopedia of Science. Lưu trữ bản gốc ngày 10 tháng 8 năm 2016. Truy cập ngày 27 tháng 12 năm 2012.
- ^ a b c d e f Nakayama, Takuro; Archibald, John M (2012). “Evolving a photosynthetic organelle”. BMC Biology. 10 (1): 35. doi:10.1186/1741-7007-10-35. PMC 3337241. PMID 22531210.
- ^ a b c d e McFadden, G. I. (2001). “Chloroplast Origin and Integration”. Plant Physiology. 125 (1): 50–3. doi:10.1104/pp.125.1.50. PMC 1539323. PMID 11154294.
- ^ Archibald, John M. (2009). “The Puzzle of Plastid Evolution”. Current Biology. 19 (2): R81–8. doi:10.1016/j.cub.2008.11.067. PMID 19174147.
- ^ a b c d e f g h i j k l m n o p q r s t u v w Wise, edited by Robert R.; Hoober, J. Kenneth (2006). The structure and function of plastids. Dordrecht: Springer. tr. 3–21. ISBN 978-1-4020-4061-0. Lưu trữ bản gốc ngày 8 tháng 3 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.Quản lý CS1: văn bản dư: danh sách tác giả (liên kết)
- ^ a b Ball, S.; Colleoni, C.; Cenci, U.; Raj, J. N.; Tirtiaux, C. (2011). “The evolution of glycogen and starch metabolism in eukaryotes gives molecular clues to understand the establishment of plastid endosymbiosis”. Journal of Experimental Botany. 62 (6): 1775–801. doi:10.1093/jxb/erq411. PMID 21220783.
- ^ a b c d e Nair, Sethu C.; Striepen, Boris (2011). “What Do Human Parasites Do with a Chloroplast Anyway?”. PLoS Biology. 9 (8): e1001137. doi:10.1371/journal.pbio.1001137. PMC 3166169. PMID 21912515.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah Keeling, P. J. (2010). “The endosymbiotic origin, diversification and fate of plastids”. Philosophical Transactions of the Royal Society B: Biological Sciences. 365 (1541): 729–48. doi:10.1098/rstb.2009.0103. PMC 2817223. PMID 20124341.
- ^ a b c d e f g h i Biology 8th Edition Campbell & Reece. Benjamin Cummings (Pearson). 2009. tr. 582–92.
- ^ “rhodo-”. The Free Dictionary. Farlex. Lưu trữ bản gốc ngày 21 tháng 8 năm 2016. Truy cập ngày 7 tháng 6 năm 2013.
- ^ a b Lewis, L. A.; McCourt, R. M. (2004). “Green algae and the origin of land plants”. American Journal of Botany. 91 (10): 1535–56. doi:10.3732/ajb.91.10.1535. PMID 21652308.
- ^ Machida, M.; Takechi, K; Sato, H; Chung, SJ; Kuroiwa, H; Takio, S; Seki, M; Shinozaki, K; Fujita, T; Hasebe, M; Takano, H (2006). “Genes for the peptidoglycan synthesis pathway are essential for chloroplast division in moss”. Proceedings of the National Academy of Sciences. 103 (17): 6753–8. Bibcode:2006PNAS..103.6753M. doi:10.1073/pnas.0510693103. PMC 1458953. PMID 16618924.
- ^ Moroney, J. V.; Somanchi, A (1999). “How Do Algae Concentrate CO2 to Increase the Efficiency of Photosynthetic Carbon Fixation?”. Plant Physiology. 119 (1): 9–16. doi:10.1104/pp.119.1.9. PMC 1539202. PMID 9880340.
- ^ Tartar, AuréLien; Boucias, Drion G. (2004). “The non-photosynthetic, pathogenic green alga Helicosporidium sp. Has retained a modified, functional plastid genome”. FEMS Microbiology Letters. 233 (1): 153–7. doi:10.1016/j.femsle.2004.02.006. PMID 15043882.
- ^ a b Chaal, Balbir K.; Green, Beverley R. (tháng 2 năm 2005). “Protein import pathways in 'complex' chloroplasts derived from secondary endosymbiosis involving a red algal ancestor”. Plant Molecular Biology. 57 (3): 333–42. doi:10.1007/s11103-004-7848-y. PMID 15830125.
- ^ a b c Moustafa, Ahmed; Beszteri, Bánk; Maier, Uwe G.; Bowler, Chris; Valentin, Klaus; Bhattacharya, Debashish (2009). “Genomic Footprints of a Cryptic Plastid Endosymbiosis in Diatoms”. Science. 324 (5935): 1724–6. Bibcode:2009Sci...324.1724M. doi:10.1126/science.1172983. PMID 19556510.
- ^ Rogers, M. B.; Gilson, P. R.; Su, V.; McFadden, G. I.; Keeling, P. J. (2006). “The Complete Chloroplast Genome of the Chlorarachniophyte Bigelowiella natans: Evidence for Independent Origins of Chlorarachniophyte and Euglenid Secondary Endosymbionts”. Molecular Biology and Evolution. 24 (1): 54–62. doi:10.1093/molbev/msl129. PMID 16990439.
- ^ a b c d e f g h i j k l m n Hackett, J. D.; Anderson, D. M.; Erdner, D. L.; Bhattacharya, D. (2004). “Dinoflagellates: A remarkable evolutionary experiment”. American Journal of Botany. 91 (10): 1523–34. doi:10.3732/ajb.91.10.1523. PMID 21652307.
- ^ Dorrell, R. G.; Smith, A. G. (2011). “Do Red and Green Make Brown?: Perspectives on Plastid Acquisitions within Chromalveolates”. Eukaryotic Cell. 10 (7): 856–68. doi:10.1128/EC.00326-10. PMC 3147421. PMID 21622904.
- ^ Meeson, B. W.; Chang, S. S.; Sweeney, B. M. (1982). “Characterization of Peridinin-Chlorophyll α-Proteins from the Marine Dinoflagellate Ceratium furca”. Botanica Marina. 25 (8): 347–50. doi:10.1515/botm.1982.25.8.347.
- ^ a b c Tengs, T; Dahlberg, OJ; Shalchian-Tabrizi, K; Klaveness, D; Rudi, K; Delwiche, CF; Jakobsen, KS (2000). “Phylogenetic analyses indicate that the 19'Hexanoyloxy-fucoxanthin-containing dinoflagellates have tertiary plastids of haptophyte origin”. Molecular Biology and Evolution. 17 (5): 718–29. doi:10.1093/oxfordjournals.molbev.a026350. PMID 10779532. Lưu trữ bản gốc ngày 24 tháng 4 năm 2018. Truy cập ngày 24 tháng 4 năm 2018.
- ^ a b c Schnepf, Eberhard; Elbrächter, Malte (1999). “Dinophyte chloroplasts and phylogeny – A review”. Grana. 38 (2–3): 81–97. doi:10.1080/00173139908559217.
- ^ a b c d Nowack, E. C. M.; Vogel, H.; Groth, M.; Grossman, A. R.; Melkonian, M.; Glöckner, G. (2010). “Endosymbiotic Gene Transfer and Transcriptional Regulation of Transferred Genes in Paulinella chromatophora”. Molecular Biology and Evolution. 28 (1): 407–22. doi:10.1093/molbev/msq209. PMID 20702568.
- ^ a b c d e Dann, Leighton (2002). Bioscience—Explained. Green DNA: BIOSCIENCE EXPLAINED. Lưu trữ bản gốc ngày 18 tháng 4 năm 2016. Truy cập ngày 24 tháng 4 năm 2018.
- ^ a b c d e Clegg, M. T.; Gaut, BS; Learn Jr, GH; Morton, BR (1994). “Rates and Patterns of Chloroplast DNA Evolution”. Proceedings of the National Academy of Sciences. 91 (15): 6795–801. Bibcode:1994PNAS...91.6795C. doi:10.1073/pnas.91.15.6795. PMC 44285. PMID 8041699.
- ^ a b c d e f Shaw, J.; Lickey, E. B.; Schilling, E. E.; Small, R. L. (2007). “Comparison of whole chloroplast genome sequences to choose noncoding regions for phylogenetic studies in angiosperms: The tortoise and the hare III”. American Journal of Botany. 94 (3): 275–88. doi:10.3732/ajb.94.3.275. PMID 21636401.
- ^ Skovgaard, Alf (1998). “Role of chloroplast retention in a marine dinoflagellate”. Aquatic Microbial Ecology. 15: 293–301. doi:10.3354/ame015293.
- ^ C.Michael Hogan. 2010. Deoxyribonucleic acid. Encyclopedia of Earth. National Council for Science and the Environment. eds. S.Draggan and C.Cleveland. Washington DC
- ^ “ctDNA — chloroplast DNA”. AllAcronyms.com. Lưu trữ bản gốc ngày 24 tháng 4 năm 2018. Truy cập ngày 2 tháng 1 năm 2013.
- ^ The Oxford Dictionary of Abbreviations. ctDNA—Dictionary definition. 1998. Lưu trữ bản gốc ngày 24 tháng 4 năm 2018. Truy cập ngày 24 tháng 4 năm 2018.
- ^ “Chloroplasts and Other Plastids”. University of Hamburg. Bản gốc lưu trữ ngày 20 tháng 10 năm 2013. Truy cập ngày 27 tháng 12 năm 2012.
- ^ a b c d e f g Sandelius, Anna Stina (2009). The Chloroplast: Interactions with the Environment. Springer. tr. 18. ISBN 978-3-540-68696-5. Lưu trữ bản gốc ngày 18 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ a b Burgess, Jeremy (1989). An introduction to plant cell development. Cambridge: Cambridge university press. tr. 62. ISBN 0-521-31611-1. Lưu trữ bản gốc ngày 18 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ Bendich, A. J. (2004). “Circular Chloroplast Chromosomes: The Grand Illusion”. The Plant Cell Online. 16 (7): 1661–6. doi:10.1105/tpc.160771. PMC 514151. PMID 15235123.
- ^ a b c Kolodner, R.; Tewari, KK (1979). “Inverted Repeats in Chloroplast DNA from Higher Plants”. Proceedings of the National Academy of Sciences. 76 (1): 41–5. Bibcode:1979PNAS...76...41K. doi:10.1073/pnas.76.1.41. PMC 382872. PMID 16592612.
- ^ a b Palmer, Jeffrey D.; Thompson, William F. (1982). “Chloroplast DNA rearrangements are more frequent when a large inverted repeat sequence is lost”. Cell. 29 (2): 537–50. doi:10.1016/0092-8674(82)90170-2. PMID 6288261.
- ^ Plant Biochemistry (ấn bản 3). Academic Press. 2005. tr. 517. ISBN 978-0-12-088391-2.
- ^ a b Kobayashi, T.; Takahara, M; Miyagishima, SY; Kuroiwa, H; Sasaki, N; Ohta, N; Matsuzaki, M; Kuroiwa, T (2002). “Detection and Localization of a Chloroplast-Encoded HU-Like Protein That Organizes Chloroplast Nucleoids”. The Plant Cell Online. 14 (7): 1579–89. doi:10.1105/tpc.002717. PMC 150708. PMID 12119376.
- ^ a b c d e f Krishnan, Rao BJ, NM (2009). “A comparative approach to elucidate chloroplast genome replication”. BMC Genomics. 10 (237). doi:10.1186/1471-2164-10-237.
- ^ Heinhorst, Gordon C. Cannon, Sabine (1993). “DNA replication in chloroplasts”. Journal of Cell Science. 104: 1–9.
- ^ a b c d e f Bendich, AJ (2004). “Circular Chloroplast Chromosomes: The Grand Illusion”. The Plant Cell. 16 (7): 1661–1666. doi:10.1105/tpc.160771. PMC 514151. PMID 15235123.
- ^ “Effect of chemical mutagens on nucleotide sequence”. Biocyclopedia. Lưu trữ bản gốc ngày 7 tháng 3 năm 2016. Truy cập ngày 24 tháng 10 năm 2015.
- ^ a b Alberts, Bruce (2002). Molecular biology of the cell (ấn bản 4.). New York [u.a.]: Garland. ISBN 0-8153-4072-9. Lưu trữ bản gốc ngày 25 tháng 9 năm 2019. Truy cập ngày 29 tháng 7 năm 2016.
- ^ Huang, Chun Y.; Ayliffe, Michael A.; Timmis, Jeremy N. (2003). “Direct measurement of the transfer rate of chloroplast DNA into the nucleus”. Nature. 422 (6927): 72–6. Bibcode:2003Natur.422...72H. doi:10.1038/nature01435. PMID 12594458.
- ^ a b c Martin, W.; Rujan, T; Richly, E; Hansen, A; Cornelsen, S; Lins, T; Leister, D; Stoebe, B; Hasegawa, M; Penny, D (2002). “Evolutionary analysis of Arabidopsis, cyanobacterial, and chloroplast genomes reveals plastid phylogeny and thousands of cyanobacterial genes in the nucleus”. Proceedings of the National Academy of Sciences. 99 (19): 12246–51. Bibcode:2002PNAS...9912246M. doi:10.1073/pnas.182432999. PMC 129430. PMID 12218172.
- ^ Smith, David Roy; Lee, Robert W. (ngày 1 tháng 4 năm 2014). “A Plastid without a Genome: Evidence from the Nonphotosynthetic Green Algal Genus Polytomella”. Plant Physiology. 164 (4): 1812–1819. doi:10.1104/pp.113.233718. ISSN 1532-2548. PMC 3982744. PMID 24563281. Lưu trữ bản gốc ngày 25 tháng 8 năm 2017. Truy cập ngày 29 tháng 7 năm 2016.
- ^ Archibald, John M. (2006). “Algal Genomics: Exploring the Imprint of Endosymbiosis”. Current Biology. 16 (24): R1033–5. doi:10.1016/j.cub.2006.11.008. PMID 17174910.
- ^ Koussevitzky, Shai; Nott, Ajit; Mockler, Todd C.; Hong, Fangxin; Sachetto-Martins, Gilberto; Surpin, Marci; Lim, Jason; Mittler, Ron; Chory, Joanne (4 tháng 5 năm 2007). “Signals from chloroplasts converge to regulate nuclear gene expression”. Science (New York, N.Y.). 316 (5825): 715–719. doi:10.1126/science.1142703. ISSN 1095-9203. PMID 17395793.
- ^ Hedtke, B.; Börner, T; Weihe, A (1997). “Mitochondrial and Chloroplast Phage-Type RNA Polymerases in Arabidopsis”. Science. 277 (5327): 809–11. doi:10.1126/science.277.5327.809. PMID 9242608.
- ^ Harris, EH; Boynton, JE; Gillham, NW (1994). “Chloroplast ribosomes and protein synthesis”. Microbiological reviews. 58 (4): 700–54. PMC 372988. PMID 7854253.
- ^ a b c d e f g h i j Soll, Jürgen; Schleiff, Enrico (2004). “Plant cell biology: Protein import into chloroplasts”. Nature Reviews Molecular Cell Biology. 5 (3): 198–208. doi:10.1038/nrm1333. PMID 14991000.
- ^ Biology 8th edition—Campbell & Reece. Benjamin Cummings. 2008. tr. 340. ISBN 978-0-321-54325-7.
- ^ Lung, S.-C.; Chuong, S. D. X. (2012). “A Transit Peptide-Like Sorting Signal at the C Terminus Directs the Bienertia sinuspersici Preprotein Receptor Toc159 to the Chloroplast Outer Membrane”. The Plant Cell. 24 (4): 1560–78. doi:10.1105/tpc.112.096248. PMC 3398564. PMID 22517318.
- ^ Soll, J r.; Soll, J (1996). “Phosphorylation of the Transit Sequence of Chloroplast Precursor Proteins”. Journal of Biological Chemistry. 271 (11): 6545–54. doi:10.1074/jbc.271.11.6545. PMID 8626459.
- ^ a b May, T. (2000). “14-3-3 Proteins Form a Guidance Complex with Chloroplast Precursor Proteins in Plants”. The Plant Cell Online. 12: 53–64. doi:10.1105/tpc.12.1.53.
- ^ Jarvis, Paul; Soll, Jürgen (2001). “Toc, Tic, and chloroplast protein import”. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1541 (1–2): 64–79. doi:10.1016/S0167-4889(01)00147-1. PMID 11750663.
- ^ Wise, R.R.; Hoober, J.K. (2007). The Structure and Function of Plastids. Springer. tr. 32–33. ISBN 978-1-4020-6570-5. Lưu trữ bản gốc ngày 19 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ “Oedogonium Link ex Hirn, 1900: 17”. algaeBASE. Lưu trữ bản gốc ngày 6 tháng 9 năm 2018. Truy cập ngày 19 tháng 5 năm 2013.
- ^ “Chlamydomonas Ehrenberg, 1833: 288”. algaeBASE. Lưu trữ bản gốc ngày 6 tháng 9 năm 2018. Truy cập ngày 19 tháng 5 năm 2013.
- ^ “Sirogonium Kützing, 1843: 278”. algaeBASE. Lưu trữ bản gốc ngày 6 tháng 9 năm 2018. Truy cập ngày 19 tháng 5 năm 2013.
- ^ “Spirogyra Link, 1820: 5”. algaeBASE. Lưu trữ bản gốc ngày 6 tháng 9 năm 2018. Truy cập ngày 19 tháng 5 năm 2013.
- ^ “Zygnema C.Agardh, 1817: xxxii, 98”. algaeBASE. Lưu trữ bản gốc ngày 6 tháng 9 năm 2018. Truy cập ngày 19 tháng 5 năm 2013.
- ^ “Micrasterias C.Agardh ex Ralfs, 1848: 68”. algaeBASE. Lưu trữ bản gốc ngày 25 tháng 2 năm 2016. Truy cập ngày 19 tháng 5 năm 2013.
- ^ John, D.M.; Brook, A.J.; Whitton, B.A. (2002). The freshwater algal flora of the British Isles: an identification guide to freshwater and terrestrial algae. Cambridge: Cambridge University Press. tr. 335. ISBN 978-0-521-77051-4. Lưu trữ bản gốc ngày 19 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ a b c d e f g Biology 8th edition—Campbell & Reece. Benjamin Cummings. 2008. tr. 196–197. ISBN 978-0-321-54325-7.
- ^ Koike, H.; Yoshio, M.; Kashino, Y.; Satoh, K. (1998). “Polypeptide Composition of Envelopes of Spinach Chloroplasts: Two Major Proteins Occupy 90% of Outer Envelope Membranes”. Plant and Cell Physiology. 39 (5): 526–32. doi:10.1093/oxfordjournals.pcp.a029400. PMID 9664716.
- ^ Köhler RH, Hanson MR (ngày 1 tháng 1 năm 2000). “Plastid tubules of higher plants are tissue-specific and developmentally regulated”. J. Cell. Sci. 113 (Pt 1): 81–9. PMID 10591627. Lưu trữ bản gốc ngày 18 tháng 11 năm 2010. Truy cập ngày 29 tháng 7 năm 2016.
- ^ Gray JC, Sullivan JA, Hibberd JM, Hansen MR (2001). “Stromules: mobile protrusions and interconnections between plastids”. Plant Biology. 3 (3): 223–33. doi:10.1055/s-2001-15204.
- ^ Schattat, M.; Barton, K.; Baudisch, B.; Klösgen, R. B.; Mathur, J. (2011). “Plastid Stromule Branching Coincides with Contiguous Endoplasmic Reticulum Dynamics”. Plant Physiology. 155 (4): 1667–77. doi:10.1104/pp.110.170480. PMC 3091094. PMID 21273446.
- ^ Schattat, M. H.; Griffiths, S.; Mathur, N.; Barton, K.; Wozny, M. R.; Dunn, N.; Greenwood, J. S.; Mathur, J. (2012). “Differential Coloring Reveals That Plastids Do Not Form Networks for Exchanging Macromolecules”. The Plant Cell. 24 (4): 1465–77. doi:10.1105/tpc.111.095398. PMC 3398557. PMID 22474180.
- ^ Brunkard, Jacob O.; Runkel, Anne M.; Zambryski, Patricia C. (2015). “Chloroplasts extend stromules independently and in response to internal redox signals”. PNAS. 112 (32): 10044–10049. doi:10.1073/pnas.1511570112.
- ^ a b c d e f g h i j Burgess, Jeremy (1989). An introduction to plant cell development . Cambridge: Cambridge university press. tr. 46. ISBN 0-521-31611-1. Lưu trữ bản gốc ngày 18 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ a b Whatley, Jean M (ngày 5 tháng 7 năm 1994). “The occurrence of a peripheral reticulum in plastids of the gymnosperm Welwitschia mirabilis”. New Phytologist. 74 (2): 215–220. doi:10.1111/j.1469-8137.1975.tb02608.x.
- ^ a b c Wise, Robert R (2007). The Structure and Function of Plastids. Springer. tr. 17–18. ISBN 978-1-4020-6570-5. Lưu trữ bản gốc ngày 19 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ Manuell, Andrea L.; Quispe, Joel; Mayfield, Stephen P. (2007). “Structure of the Chloroplast Ribosome: Novel Domains for Translation Regulation”. PLoS Biology. 5 (8): e209. doi:10.1371/journal.pbio.0050209. PMC 1939882. PMID 17683199.
- ^ a b Lim, K.; Kobayashi, I.; Nakai, K. (ngày 7 tháng 4 năm 2014). “Alterations in rRNA-mRNA Interaction during Plastid Evolution”. Molecular Biology and Evolution. 31 (7): 1728–1740. doi:10.1093/molbev/msu120.
- ^ Hirose, T; Sugiura, M (tháng 1 năm 2004). “Functional Shine-Dalgarno-like sequences for translational initiation of chloroplast mRNAs”. Plant & cell physiology. 45 (1): 114–7. doi:10.1093/pcp/pch002. PMID 14749493.
- ^ Ma, J; Campbell, A; Karlin, S (tháng 10 năm 2002). “Correlations between Shine-Dalgarno sequences and gene features such as predicted expression levels and operon structures”. Journal of Bacteriology. 184 (20): 5733–45. doi:10.1128/JB.184.20.5733-5745.2002. PMID 12270832.
- ^ Lim, K; Furuta, Y; Kobayashi, I (tháng 10 năm 2012). “Large variations in bacterial ribosomal RNA genes”. Molecular Biology and Evolution. 29 (10): 2937–48. doi:10.1093/molbev/mss101. PMID 22446745.
- ^ a b c d e f g h i j Austin, J. R.; Frost, E; Vidi, PA; Kessler, F; Staehelin, LA (2006). “Plastoglobules Are Lipoprotein Subcompartments of the Chloroplast That Are Permanently Coupled to Thylakoid Membranes and Contain Biosynthetic Enzymes”. The Plant Cell Online. 18 (7): 1693–703. doi:10.1105/tpc.105.039859. PMC 1488921. PMID 16731586.
- ^ a b Crumpton-Taylor, M.; Grandison, S.; Png, K. M. Y.; Bushby, A. J.; Smith, A. M. (2011). “Control of Starch Granule Numbers in Arabidopsis Chloroplasts”. Plant Physiology. 158 (2): 905–16. doi:10.1104/pp.111.186957. PMC 3271777. PMID 22135430.
- ^ Zeeman, Samuel C.; Delatte, Thierry; Messerli, Gaëlle; Umhang, Martin; Stettler, Michaela; Mettler, Tabea; Streb, Sebastian; Reinhold, Heike; Kötting, Oliver (2007). “Starch breakdown: Recent discoveries suggest distinct pathways and novel mechanisms”. Functional Plant Biology. 34 (6): 465–73. doi:10.1071/FP06313.
- ^ J D, Rochaix (1998). The molecular biology of chloroplasts and mitochondria in Chlamydomonas. Dordrecht [u.a.]: Kluwer Acad. Publ. tr. 550–565. ISBN 978-0-7923-5174-0. Lưu trữ bản gốc ngày 31 tháng 7 năm 2020. Truy cập ngày 29 tháng 7 năm 2016.
- ^ a b c d e f Steer, Brian E.S. Gunning, Martin W. (1996). Plant cell biology: structure and function. Boston, Mass.: Jones and Bartlett Publishers. tr. 24. ISBN 0-86720-504-0. Lưu trữ bản gốc ngày 19 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ Hanson, David; Andrews, T. John; Badger, Murray R. (2002). “Variability of the pyrenoid-based CO2 concentrating mechanism in hornworts (Anthocerotophyta)”. Functional Plant Biology. 29 (3): 407–16. doi:10.1071/PP01210.
- ^ a b Ma, Y.; Pollock, S. V.; Xiao, Y.; Cunnusamy, K.; Moroney, J. V. (2011). “Identification of a Novel Gene, CIA6, Required for Normal Pyrenoid Formation in Chlamydomonas reinhardtii”. Plant Physiology. 156 (2): 884–96. doi:10.1104/pp.111.173922. PMC 3177283. PMID 21527423.
- ^ a b Retallack, B; Butler, RD (1970). “The development and structure of pyrenoids in Bulbochaete hiloensis”. Journal of Cell Science. 6 (1): 229–41. PMID 5417694.
- ^ Brown, Malcolm R; Howard J Arnott (1970). “Structure and Function of the Algal Pyrenoid” (PDF). Journal of Phycology. 6: 14–22. doi:10.1111/j.1529-8817.1970.tb02350.x. Lưu trữ (PDF) bản gốc ngày 4 tháng 3 năm 2016. Truy cập ngày 31 tháng 12 năm 2012.
- ^ a b c d e f Mustardy, L.; Buttle, K.; Steinbach, G.; Garab, G. (2008). “The Three-Dimensional Network of the Thylakoid Membranes in Plants: Quasihelical Model of the Granum-Stroma Assembly”. The Plant Cell Online. 20 (10): 2552–7. doi:10.1105/tpc.108.059147. PMC 2590735. PMID 18952780.
- ^ a b c Austin, J. R.; Staehelin, L. A. (2011). “Three-Dimensional Architecture of Grana and Stroma Thylakoids of Higher Plants as Determined by Electron Tomography”. Plant Physiology. 155 (4): 1601–11. doi:10.1104/pp.110.170647. PMC 3091084. PMID 21224341.
- ^ “The Chloroplast Import Receptor Toc90 Partially Restores the Accumulation of Toc159 Client Proteins in the Arabidopsis thaliana ppi2 Mutant”. Molecular Plant. Lưu trữ bản gốc ngày 16 tháng 1 năm 2021. Truy cập ngày 19 tháng 5 năm 2013.Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
- ^ “thylakoid”. Merriam-Webster Dictionary. Merriam-Webster. Lưu trữ bản gốc ngày 9 tháng 8 năm 2016. Truy cập ngày 19 tháng 5 năm 2013.
- ^ a b c Biology 8th Edition Campbell & Reece. Benjamin Cummings (Pearson). 2009. tr. 190–193.
- ^ “Australian scientists discover first new chlorophyll in 60 years”. University of Sydney. ngày 20 tháng 8 năm 2010. Lưu trữ bản gốc ngày 8 tháng 4 năm 2019. Truy cập ngày 24 tháng 4 năm 2018.
- ^ a b c Takaichi, Shinichi (ngày 15 tháng 6 năm 2011). “Carotenoids in Algae: Distributions, Biosyntheses and Functions”. Marine Drugs. 9 (12): 1101–1118. doi:10.3390/md9061101. PMC 3131562. PMID 21747749.
- ^ Shapley, Dan. “Why Do Leaves Change Color in Fall?”. News Articles. Lưu trữ bản gốc ngày 24 tháng 4 năm 2018. Truy cập ngày 21 tháng 5 năm 2013.
- ^ a b Howe, C.J; Barbrook, A.C; Nisbet, R.E.R; Lockhart, P.J; Larkum, A.W.D (2008). “The origin of plastids”. Philosophical Transactions of the Royal Society B: Biological Sciences. 363 (1504): 2675–85. doi:10.1098/rstb.2008.0050. PMC 2606771. PMID 18468982.
- ^ “Introduction to the Rhodophyta”. University of California Museum of Paleontology. Lưu trữ bản gốc ngày 18 tháng 12 năm 2008. Truy cập ngày 20 tháng 5 năm 2013.
- ^ a b c d e f g Biology 8th Edition Campbell & Reece. Benjamin Cummings (Pearson). 2009. tr. 200–201.
- ^ Lawton, June R (tháng 3 năm 1988). “Ultrastructure of Chloroplast Membranes in Leaves of Maize and Ryegrass as Revealed by Selective Staining Methods”. New Phytologist. 108 (3): 277–283. doi:10.1111/j.1469-8137.1988.tb04163.x. JSTOR 2433294.
- ^ Roberts, editor, Keith (2007). Handbook of plant science. Chichester, West Sussex, England: Wiley. tr. 16. ISBN 978-0-470-05723-0. Lưu trữ bản gốc ngày 18 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.Quản lý CS1: văn bản dư: danh sách tác giả (liên kết)
- ^ Biology 8th edition—Campbell&Reece. Benjamin Cummings. 2008. tr. 742. ISBN 978-0-321-54325-7.
- ^ a b “Guard Cell Photosynthesis”. Plant Physiology Online. Sinauer. Lưu trữ bản gốc ngày 24 tháng 7 năm 2011. Truy cập ngày 14 tháng 4 năm 2013.
- ^ a b Eckardt, N. A. (2003). “Controlling Organelle Positioning: A Novel Chloroplast Movement Protein”. The Plant Cell Online. 15 (12): 2755–7. doi:10.1105/tpc.151210. PMC 540263.
- ^ a b c d e f g h i j k l Glynn, Jonathan M.; Miyagishima, Shin-ya; Yoder, David W.; Osteryoung, Katherine W.; Vitha, Stanislav (2007). “Chloroplast Division”. Traffic. 8 (5): 451–61. doi:10.1111/j.1600-0854.2007.00545.x. PMID 17451550.
- ^ a b Dong, X.-J.; Nagai, R.; Takagi, S. (1998). “Microfilaments Anchor Chloroplasts along the Outer Periclinal Wall in Vallisneria Epidermal Cells through Cooperation of PFR and Photosynthesis”. Plant and Cell Physiology. 39 (12): 1299–306. doi:10.1093/oxfordjournals.pcp.a029334.
- ^ a b c Takagi, Shingo (tháng 12 năm 2002). “Actin-based photo-orientation movement of chloroplasts in plant cells”. Journal of Experimental Biology. 206: 1963–1969. doi:10.1242/jeb.00215. Lưu trữ bản gốc ngày 29 tháng 8 năm 2016. Truy cập ngày 6 tháng 3 năm 2013.
- ^ Zeiger, E.; Talbott, L. D.; Frechilla, S.; Srivastava, A.; Zhu, J. (2002). “The guard cell chloroplast: A perspective for the twenty-first century”. New Phytologist. 153 (3): 415–424. doi:10.1046/j.0028-646X.2001.NPH328.doc.x.
- ^ a b c d e f g Padmanabhan, Meenu S.; Dinesh-Kumar, S. P. (2010). “All Hands on Deck—The Role of Chloroplasts, Endoplasmic Reticulum, and the Nucleus in Driving Plant Innate Immunity”. Molecular Plant-Microbe Interactions. 23 (11): 1368–80. doi:10.1094/MPMI-05-10-0113. PMID 20923348.
- ^ Lại Thị Ngọc Hà; Vũ Thị Thư (2009). “Stress oxy hóa và các chất chống oxy hóa tự nhiên” (PDF). Khoa học và Phát triển. 7 (5): 667–677. Lưu trữ (PDF) bản gốc ngày 22 tháng 8 năm 2016. Truy cập ngày 31 tháng 7 năm 2016.
- ^ Katsir, Leron; Chung, Hoo Sun; Koo, Abraham JK; Howe, Gregg A (2008). “Jasmonate signaling: A conserved mechanism of hormone sensing”. Current Opinion in Plant Biology. 11 (4): 428–35. doi:10.1016/j.pbi.2008.05.004. PMC 2560989. PMID 18583180.
- ^ Schnurr, J. A.; Shockey, JM; De Boer, GJ; Browse, JA (2002). “Fatty Acid Export from the Chloroplast. Molecular Characterization of a Major Plastidial Acyl-Coenzyme a Synthetase from Arabidopsis”. Plant Physiology. 129 (4): 1700–9. doi:10.1104/pp.003251. PMC 166758. PMID 12177483.
- ^ a b c d Biology—Concepts and Connections. Pearson. 2009. tr. 108–118.
- ^ Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7. Lưu trữ bản gốc ngày 2 tháng 11 năm 2014. Truy cập ngày 29 tháng 7 năm 2016.[cần số trang]
- ^ Jagendorf A. T. and E. Uribe (1966). “ATP formation caused by acid-base transition of spinach chloroplasts”. Proc. Natl. Acad. Sci. USA. 55: 170–177. doi:10.1073/pnas.55.1.170.
- ^ a b Clarke, Jeremy M. Berg; John L. Tymoczko; Lubert Stryer. Web content by Neil D. (2002). Biochemistry . New York, NY [u.a.]: W. H. Freeman. tr. Section 19.4. ISBN 0-7167-3051-0. Lưu trữ bản gốc ngày 16 tháng 1 năm 2021. Truy cập ngày 29 tháng 7 năm 2016.
- ^ a b Clarke, Jeremy M. Berg; John L. Tymoczko; Lubert Stryer. Web content by Neil D. (2002). Biochemistry . New York, NY [u.a.]: W. H. Freeman. tr. Section 20.1. ISBN 0-7167-3051-0.
- ^ a b c Wample, R. L.; Davis, R. W. (1983). “Effect of Flooding on Starch Accumulation in Chloroplasts of Sunflower (Helianthus annuus L.)”. Plant Physiology. 73 (1): 195–8. doi:10.1104/pp.73.1.195. PMC 1066435. PMID 16663176.
- ^ Carmi, A.; Shomer, I. (1979). “Starch Accumulation and Photosynthetic Activity in Primary Leaves of Bean (Phaseolus vulgaris L.)”. Annals of Botany. 44 (4): 479–484. doi:10.1093/oxfordjournals.aob.a085756. Lưu trữ bản gốc ngày 24 tháng 4 năm 2018. Truy cập ngày 24 tháng 4 năm 2018.
- ^ Berg JM; Tymoczko JL; Stryer L. (2002). Biochemistry (ấn bản 5). W H Freeman. tr. Section 19.4. Lưu trữ bản gốc ngày 16 tháng 1 năm 2021. Truy cập ngày 30 tháng 10 năm 2012.
- ^ a b c Hauser, M; Eichelmann, H; Oja, V; Heber, U; Laisk, A (1995). “Stimulation by Light of Rapid pH Regulation in the Chloroplast Stroma in Vivo as Indicated by CO2 Solubilization in Leaves”. Plant Physiology. 108 (3): 1059–1066. doi:10.1104/pp.108.3.1059. PMC 157457. PMID 12228527.
- ^ a b Werdan, Karl; Heldt, Hans W.; Milovancev, Mirjana (1975). “The role of pH in the regulation of carbon fixation in the chloroplast stroma. Studies on CO2 fixation in the light and dark”. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 396 (2): 276–92. doi:10.1016/0005-2728(75)90041-9. PMID 239746.
- ^ a b c d e f g Burgess, Jeremy (1989). An introduction to plant cell development. Cambridge: Cambridge university press. tr. 56. ISBN 0-521-31611-1. Lưu trữ bản gốc ngày 18 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ Ferro, Myriam; Daniel Salvi; Hélène Rivière-Rolland; Thierry Vermat; Daphné Seigneurin-Berny; Didier Grunwald; Jérôme Garin; Jacques Joyard; Norbert Rolland (ngày 20 tháng 8 năm 2002). “Integral membrane proteins of the chloroplast envelope: Identification and subcellular localization of new transporters”. Proceedings of the National Academy of Sciences. 99 (17): 11487–11492. Bibcode:2002PNAS...9911487F. doi:10.1073/pnas.172390399.
- ^ a b Rolland, Norbert; Michel Droux; Roland Douce (tháng 3 năm 1992). “Subcellular Distribution of O-Acetylserine(thiol)lyase in Cauliflower (Brassica oleracea L.) Inflorescence”. Plant Physiology. 98 (3): 927–935. doi:10.1104/pp.98.3.927.
- ^ Ravanel, Stéphane; Bertrand Gakière; Dominique Job; Roland Douce (ngày 23 tháng 6 năm 1998). “The specific features of methionine biosynthesis and metabolism in plants”. Proceedings of the National Academy of Sciences. 95 (13): 7805–7812. Bibcode:1998PNAS...95.7805R. doi:10.1073/pnas.95.13.7805. PMID 9636232. Lưu trữ bản gốc ngày 24 tháng 9 năm 2015. Truy cập ngày 29 tháng 7 năm 2016.
- ^ Joyard, Jacques; Ferro, Myriam; Masselon, Christophe; Seigneurin-Berny, Daphné; Salvi, Daniel; Garin, Jérôme; Rolland, Norbert (2010). “Chloroplast proteomics highlights the subcellular compartmentation of lipid metabolism”. Progress in Lipid Research. 49 (2): 128–58. doi:10.1016/j.plipres.2009.10.003. PMID 19879895.
- ^ “Chemical Composition of Chloroplasts” (bằng tiếng Anh). BiologyDiscussion.com. tr. 1. Lưu trữ bản gốc ngày 29 tháng 8 năm 2016. Truy cập ngày 17 tháng 7 năm 2016.
- ^ Steer, Brian E.S. Gunning, Martin W. (1996). Plant cell biology: structure and function. Boston, Mass.: Jones and Bartlett Publishers. tr. 20. ISBN 0-86720-504-0. Lưu trữ bản gốc ngày 19 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ a b c d e Burgess, Jeremy (1989). An introduction to plant cell development . Cambridge: Cambridge university press. tr. 54–55. ISBN 0-521-31611-1. Lưu trữ bản gốc ngày 18 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ Burgess, Jeremy (1989). An introduction to plant cell development . Cambridge: Cambridge university press. tr. 57. ISBN 0-521-31611-1. Lưu trữ bản gốc ngày 19 tháng 12 năm 2016. Truy cập ngày 29 tháng 7 năm 2016.
- ^ a b Possingham, J. V.; Rose, R. J. (1976). “Chloroplast Replication and Chloroplast DNA Synthesis in Spinach Leaves”. Proceedings of the Royal Society B: Biological Sciences. 193 (1112): 295–305. Bibcode:1976RSPSB.193..295P. doi:10.1098/rspb.1976.0047.
- ^ Heinhorst, S; G.C. Cannon (tháng 1 năm 1993). “DNA replication in chloroplasts”. Journal of Cell Science. 104 (104): 1–9. Lưu trữ bản gốc ngày 26 tháng 2 năm 2013. Truy cập ngày 3 tháng 2 năm 2013.
- ^ a b c d e f g h i Miyagishima, S.-y.; Nishida, K; Mori, T; Matsuzaki, M; Higashiyama, T; Kuroiwa, H; Kuroiwa, T (2003). “A Plant-Specific Dynamin-Related Protein Forms a Ring at the Chloroplast Division Site”. The Plant Cell Online. 15 (3): 655–65. doi:10.1105/tpc.009373. PMC 150020. PMID 12615939.
- ^ a b Hashimoto, H.; Possingham, J. V. (1989). “Effect of Light on the Chloroplast Division Cycle and DNA Synthesis in Cultured Leaf Discs of Spinach”. Plant Physiology. 89 (4): 1178–83. doi:10.1104/pp.89.4.1178. PMC 1055993. PMID 16666681.
- ^ a b c d Hansen, A. K.; Escobar, L. K.; Gilbert, L. E.; Jansen, R. K. (2007). “Paternal, maternal, and biparental inheritance of the chloroplast genome in Passiflora (Passifloraceae): Implications for phylogenetic studies”. American Journal of Botany. 94 (1): 42–6. doi:10.3732/ajb.94.1.42. PMID 21642206.
- ^ Birky, C. William (1995). “Uniparental Inheritance of Mitochondrial and Chloroplast Genes: Mechanisms and Evolution”. Proceedings of the National Academy of Sciences. 92 (25): 11331–8. Bibcode:1995PNAS...9211331B. doi:10.1073/pnas.92.25.11331. PMC 40394. PMID 8524780.
- ^ Powell W, Morgante M, McDevitt R, Vendramin GG, Rafalski JA (tháng 8 năm 1995). “Polymorphic simple sequence repeat regions in chloroplast genomes: applications to the population genetics of pines”. Proc. Natl. Acad. Sci. U.S.A. 92 (17): 7759–63. Bibcode:1995PNAS...92.7759P. doi:10.1073/pnas.92.17.7759. PMC 41225. PMID 7644491.
In the pines, the chloroplast genome is transmitted through pollen
- ^ Stegemann, S.; Hartmann, S; Ruf, S; Bock, R (2003). “High-frequency gene transfer from the chloroplast genome to the nucleus”. Proceedings of the National Academy of Sciences. 100 (15): 8828–33. Bibcode:2003PNAS..100.8828S. doi:10.1073/pnas.1430924100. PMC 166398. PMID 12817081.
- ^ a b Ruf, S.; Karcher, D.; Bock, R. (2007). “Determining the transgene containment level provided by chloroplast transformation”. Proceedings of the National Academy of Sciences. 104 (17): 6998–7002. Bibcode:2007PNAS..104.6998R. doi:10.1073/pnas.0700008104. PMC 1849964. PMID 17420459.
- ^ “What are the similarities and differences between chloroplasts and mitochondria?”. Quora. ngày 12 tháng 1 năm 2016. Lưu trữ bản gốc ngày 16 tháng 1 năm 2021. Truy cập ngày 24 tháng 7 năm 2016.
- ^ Vũ Văn Vụ, Đỗ Mạnh Hưng (2010). Sinh lý học thực vật. Tài liệu chuyên Sinh học Trung học phổ thông. Nhà xuất bản Giáo dục.
Liên kết ngoài sửa
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Lục lạp. |
- Chloroplast tại Encyclopædia Britannica (tiếng Anh)
- Sắc lạp tại Từ điển bách khoa Việt Nam
- Chloroplast – Cell Centered Database
- Chloroplasts Lưu trữ 2003-08-03 tại Wayback Machine, Arabidopsis thaliana chloroplast, complete genome và Photosynthesis: The Role of Light Lưu trữ 2005-12-11 tại Wayback Machine từ Kimball's Biology Pages Lưu trữ 2006-04-09 tại Wayback Machine
- Clegg, M. T.; Gaut, BS; Learn Jr, GH; Morton, BR (1994). “Rates and Patterns of Chloroplast DNA Evolution”. Proceedings of the National Academy of Sciences. 91 (15): 6795–801. Bibcode:1994PNAS...91.6795C. doi:10.1073/pnas.91.15.6795. PMC 44285. PMID 8041699.
- 3D structures of proteins associated with thylakoid membrane
- Co-Extra research on chloroplast transformation Lưu trữ 2011-07-20 tại Wayback Machine
- NCBI full chloroplast genome