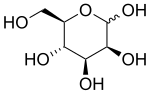
Mannose
Mannose (hay Mannoza), được đóng gói dưới dạng bổ sung dinh dưỡng "d-mannose", là một đường monome của sê-ri aldohexose Mannose là C-2 epimer của glucose. Mannose rất quan trọng trong quá trình trao đổi chất của con người, đặc biệt là trong glycosyl hóa của một số protein nhất định. Một số rối loạn bẩm sinh glycosyl hóa có liên quan đến đột biến các enzyme liên quan đến chuyển hóa mannose. [1] Mannose không phải là một chất dinh dưỡng thiết yếu; nó có thể được sản xuất trong cơ thể người từ glucose, hoặc chuyển thành glucose. Mannose cung cấp 2-5 ca-lo mỗi gam. Mannose được bài tiết một phần qua nước tiểu.
| Mannose | |
|---|---|
 | |
 | |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| MeSH | |
| ChEMBL | |
| UNII | |
| Thuộc tính | |
| Điểm nóng chảy | |
| Điểm sôi | |
| MagSus | -102.90·10−6 cm³/mol |
| Các nguy hiểm | |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Cấu trúc sửa
Mannose thường tồn tại dưới dạng hai vòng có kích thước khác nhau, dạng pyranose (sáu vòng) và dạng furanose (năm vòng). Mỗi lần đóng vòng có thể có cấu hình alpha hoặc beta ở vị trí ic anome. Hóa chất nhanh chóng trải qua đồng phân hóa trong số bốn dạng này.
| α-D-Mannofuranose | |
| α-D-Mannopyranose 67% |
β-D-Mannopyranose 33% |
Trao đổi chất sửa
Trong khi phần lớn mannose được sử dụng trong glycosyl hóa được cho là có nguồn gốc từ glucose, trong các tế bào ung thư tế bào gan nuôi cấy (tế bào ung thư từ gan), hầu hết mannose cho sinh tổng hợp glycoprotein đến từ mannose ngoại bào, không phải glucose.[2] Nhiều glycoprotein được sản xuất trong gan được tiết vào máu, do đó mannose trong chế độ ăn uống được phân phối khắp cơ thể. [3] Mannose có mặt trong nhiều glycoconjugates bao gồm cả Nglycosyl hóa liên kết với protein. C - Mannosylation cũng rất phong phú và có thể được tìm thấy ở những vùng giống như collagen.
Quá trình tiêu hóa nhiều polysacarit và glycoprotein tạo ra mannose được phosphoryl hóa bởi hexokinase để tạo ra mannose-6-phosphate. Mannose-6-phosphate được chuyển đổi thành fructose-6-phosphate, bằng enzyme phosphomannose isomerase, sau đó đi vào glycolytic pathway hoặc được chuyển đổi thành glucose-6- phosphat bằng gluconeogen pathway của hepatocytes.
Mannose là một monosacarit chiếm ưu thế trong N - glycosyl hóa liên kết. N '- glycosyl hóa liên kết là một sửa đổi protein sau dịch mã. Nó được bắt đầu bằng việc chuyển en bloc trên Glc3Man9GlcNAc2 thành glycoprotein mới sinh trong mạng lưới nội chất theo cách đồng dịch khi protein được đưa vào qua hệ thống vận chuyển. Glucose là thủy phân trên protein được gấp hoàn toàn và các phân tử mannose bị thủy phân bởi các mannosidase của ER và Golgi. Thông thường, glycoprotein người trưởng thành chỉ chứa ba dư lượng mannose được chôn dưới sự điều chỉnh tuần tự bởi GlcNAc, galactose và axit sialic. Điều này rất quan trọng vì hệ thống miễn dịch bẩm sinh ở động vật có vú được thiết kế để nhận ra dư lượng mannose tiếp xúc. Hoạt động này là do sự phổ biến của dư lượng mannose, dưới dạng mannans, trên bề mặt của men. Virus gây suy giảm miễn dịch ở người cho thấy lượng tồn dư mannose đáng kể do sự tập hợp chặt chẽ của glycans trong sự tăng đột biến của virus. [4][5] These mannose residues are the target for broadly neutralizing antibodies.[6]
Công nghệ sinh học sửa
Các protein tái tổ hợp được sản xuất trong nấm men có thể bị bổ sung mannose trong các mẫu khác với các protein được sử dụng bởi các tế bào động vật có vú.[7] Sự khác biệt về protein tái tổ hợp này từ những protein thường được sản xuất trong các sinh vật có vú có thể ảnh hưởng đến hiệu quả của vắc-xin.
Hình thành sửa
Mannose có thể được hình thành do quá trình oxy hóa mannitol.
Nó cũng có thể được hình thành từ glucose trong lobry-de Bruyn-van Ekenstein.
Từ nguyên sửa
Nguồn gốc của cả "mannose" và "mannitol" là manna, mà Kinh Thánh ghi lại là thực phẩm được cung cấp cho người Israel trong cuộc hành trình của họ ở vùng Sinai. Một số cây và cây bụi có thể tạo ra một chất gọi là manna, chẳng hạn như "cây manna" (Fraxinus ornus) từ đó dịch tiết mannitol ban đầu được phân lập.
Cấu hình sửa
Mannose khác với glucose bằng cách đảo ngược C-2 trung tâm trị liệu. Mannose hiển thị một pucker <math> ^ 4C_1 </ math> ở dạng vòng giải pháp. Sự thay đổi đơn giản này dẫn đến sự sinh hóa khác nhau mạnh mẽ của hai hexose. Thay đổi này cũng có tác dụng tương tự đối với các aldohexose khác.
Mannose PTS permease sửa
Hệ thống vận chuyển phosphotransferase phụ thuộc vào PEP vận chuyển và đồng thời phosphoryl hóa cơ chất đường của nó. Mannose XYZ permease là một thành viên của gia đình, với phương pháp riêng biệt này được sử dụng bởi vi khuẩn để hấp thu đường đặc biệt là hexose ngoại sinh trong trường hợp Mannose XYZ để giải phóng este phosphat vào tế bào chất của tế bào để chuẩn bị cho quá trình trao đổi chất chủ yếu qua con đường tế bào đường phân. [8] Phức hợp vận chuyển MANXYZ cũng liên quan đến việc nhiễm E. Coli do vi khuẩn Lambda, với tiểu đơn vị ManY và ManZ là đủ để nhiễm phage Lambda thích hợp.[9] NXYZ sở hữu bốn miền trong ba chuỗi polypeptide; ManX, ManY và ManZ. Tiểu đơn vị ManX tạo thành một homodimer được định vị ở phía tế bào chất của màng. ManX chứa hai miền IIA và IIB được liên kết bởi một peptide bản lề với mỗi miền chứa một vị trí phosphoryl hóa và chuyển phosphoryl xảy ra giữa cả hai tiểu đơn vị.[10] ManX có thể được liên kết màng hoặc không màng.[9] Các tiểu đơn vị MANY và MANZ là các protein màng tích hợp kỵ nước với sáu và một cờ lê xoắn ốc xuyên màng alpha.[11] Nhóm phosphoryl của PEP được chuyển sang đường nhập khẩu thông qua chất mang phosphat E1 (Enzyme 1), HPr (Histidine Protein) và sau đó đến các tiểu đơn vị MANX, MANY và MANZ của phức hợp vận chuyển MANXYZ tạo ra đường hexose tạo thành hexose -6-phosphat.
Xem thêm sửa
- α-Mannosidase
- Thụ thể Mannose
- Bổ sung dinh dưỡng dựa trên Man Nam oligosacarit
- Rhamnose, 6-deoxy-L-mannose
Tham khảo sửa
- ^ Freeze, H. H.; Sharma, V. (2010). “Metabolic manipulation of glycosylation disorders in humans and animal models”. Seminars in Cell & Developmental Biology. 21 (6): 655–662. doi:10.1016/j.semcdb.2010.03.011. PMC 2917643. PMID 20363348.
- ^ Alton, G.; Hasilik, M.; Niehues, R.; Panneerselvam, K.; Etchison, J. R.; Fana, F.; Freeze, H. H. (1998). “Direct utilization of mannose for mammalian glycoprotein biosynthesis”. Glycobiology. 8 (3): 285–295. doi:10.1093/glycob/8.3.285. PMID 9451038.
- ^ Davis, J. A.; Freeze, H. H. (2001). “Studies of mannose metabolism and effects of long-term mannose ingestion in the mouse”. Biochimica et Biophysica Acta. 1528 (2–3): 116–126. doi:10.1016/S0304-4165(01)00183-0. PMID 11687298.
- ^ Pritchard, Laura K.; Spencer, Daniel I. R.; Royle, Louise; Bonomelli, Camille; Seabright, Gemma E.; Behrens, Anna-Janina; Kulp, Daniel W.; Menis, Sergey; Krumm, Stefanie A. (ngày 24 tháng 6 năm 2015). “Glycan clustering stabilizes the mannose patch of HIV-1 and preserves vulnerability to broadly neutralizing antibodies”. Nature Communications (bằng tiếng Anh). 6: 7479. doi:10.1038/ncomms8479. PMC 4500839. PMID 26105115.
- ^ Pritchard, Laura K.; Vasiljevic, Snezana; Ozorowski, Gabriel; Seabright, Gemma E.; Cupo, Albert; Ringe, Rajesh; Kim, Helen J.; Sanders, Rogier W.; Doores, Katie J. (ngày 16 tháng 6 năm 2015). “Structural Constraints Determine the Glycosylation of HIV-1 Envelope Trimers”. Cell Reports (bằng tiếng Anh). 11 (10): 1604–1613. doi:10.1016/j.celrep.2015.05.017. ISSN 2211-1247. PMC 4555872. PMID 26051934.
- ^ Crispin, Max; Doores, Katie J (ngày 1 tháng 4 năm 2015). “Targeting host-derived glycans on enveloped viruses for antibody-based vaccine design”. Current Opinion in Virology. Viral pathogenesis • Preventive and therapeutic vaccines. 11: 63–69. doi:10.1016/j.coviro.2015.02.002. PMC 4827424. PMID 25747313.
- ^ Vlahopoulos, S.; Gritzapis, A. D.; Perez, S. A.; Cacoullos, N.; Papamichail, M.; Baxevanis, C. N. (2009). “Mannose addition by yeast Pichia Pastoris on recombinant HER-2 protein inhibits recognition by the monoclonal antibody herceptin”. Vaccine. 27 (34): 4704–4708. doi:10.1016/j.vaccine.2009.05.063. PMID 19520203.
- ^ Postma, P. W.; Lengeler, J. W.; Jacobson, G. R. (1993). “Phosphoenolpyruvate:carbohydrate phosphotransferase systems of bacteria”. Microbiological Reviews. 57 (3): 543–594. PMC 372926. PMID 8246840.
- ^ a b Erni, B.; Zanolari, B. (1985). “The mannose-permease of the bacterial phosphotransferase system. Gene cloning and purification of the enzyme IIMan/IIIMan complex of Escherichia coli”. The Journal of Biological Chemistry. 260 (29): 15495–15503. PMID 2999119.
- ^ Erni, B.; Zanolari, B.; Graff, P.; Kocher, H. P. (1989). “Mannose permease of Escherichia coli. Domain structure and function of the phosphorylating subunit”. The Journal of Biological Chemistry. 264 (31): 18733–18741. PMID 2681202.
- ^ Huber, F.; Erni, B. (1996). “Membrane topology of the mannose transporter of Escherichia coli K12”. European Journal of Biochemistry / FEBS. 239 (3): 810–817. doi:10.1111/j.1432-1033.1996.0810u.x. PMID 8774730.