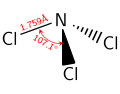Nitơ trichloride
Nitơ trichloride, còn gọi là trichloramine, là một hợp chất vô cơ có công thức hóa học NCl3. Chất lỏng có mùi dầu màu vàng, dầu cay này thường gặp nhất như là một sản phẩm phụ phản ứng hóa học giữa các chất dẫn xuất amonia và chlor (ví dụ trong bể bơi).
| Nitơ trichloride | |||
|---|---|---|---|
| |||
 Mẫu nitơ trichloride | |||
| Tên khác | Trichlorroamin Agene Nitơ(III) chloride Trichlorroazan Trichlor nitride | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| ChEBI | |||
| Số RTECS | QW974000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| ChemSpider | |||
| Tham chiếu Gmelin | 1840 | ||
| UNII | |||
| Thuộc tính | |||
| Công thức phân tử | NCl3 | ||
| Khối lượng mol | 120,3641 g/mol | ||
| Bề ngoài | chất lỏng màu vàng dầu | ||
| Mùi | giống chlor | ||
| Khối lượng riêng | 1,653 g/cm³ | ||
| Điểm nóng chảy | −40 °C (233 K; −40 °F) | ||
| Điểm sôi | 71 °C (344 K; 160 °F) | ||
| Độ hòa tan trong nước | không thể trộn lẫn phân hủy chậm | ||
| Độ hòa tan | hòa tan trong benzen, chlorrofom, CCl4, CS2, PCl3 | ||
| Cấu trúc | |||
| Cấu trúc tinh thể | Trực thoi (dưới -40 ℃) | ||
| Hình dạng phân tử | chóp ba phương | ||
| Mômen lưỡng cực | 0,6 D | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH | 232 kJ/mol | ||
| Các nguy hiểm | |||
| Phân loại của EU | không liệt kê | ||
| NFPA 704 |
| ||
| Các hợp chất liên quan | |||
| Anion khác | Nitơ trifluoride Nitơ tribromide Nitơ triiodide | ||
| Cation khác | Phosphor trichloride Asen trichloride | ||
| Nhóm chức liên quan | Chloramine Dichloramine | ||
| Hợp chất liên quan | Nitrosyl chloride | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Điều chế và cấu trúc sửa
Hợp chất được điều chế bằng cách xử lý muối amoni, như amoni nitrat với chlor.
Các chất trung gian trong chuyển đổi này bao gồm chloramine và dichloramine, NH2Cl và NHCl2.
Giống như amonia, NCl3 là một phân tử hình chóp. Khoảng cách N–Cl là 1,76 Å, và góc Cl–N–Cl là 107°.[1]
Nitơ trichloride có thể hình thành với số lượng nhỏ khi các nguồn cung cấp nước công cộng được khử trùng bằng chloramin, và trong bể bơi bằng cách khử trùng chlor phản ứng với urê trong nước tiểu và nước mồ hôi từ người tắm. Nitơ trichloride, được đăng ký nhãn hiệu Agene, được sử dụng để tẩy trắng giả tạo và bột mì, nhưng bị cấm vào năm 1949: Ở người Agene đã gây ra các rối loạn thần kinh trầm trọng và lan rộng dẫn đến việc cấm sử dụng nó vào năm 1947. Chó ăn bánh làm từ bột mì đã xử lý chất này bị như động kinh; Chất độc hại là methionine sulfoximine.[2]
Phản ứng sửa
Tính chất hóa học của NCl3 đã được khai thác tốt[3]. Nó cực vừa phải với moment lưỡng cực là 0,6 D. Trung tâm nitơ là cơ bản nhưng ít hơn amonia. Nó thủy phân bằng nước nóng để giải phóng amonia và acid hypochlorrơ.
- NCl3 + 3H2O → NH3 + 3HOCl
NCl3 phát nổ cho N2 và khí chlor. Phản ứng này được ức chế đối với các khí pha loãng.
An toàn sửa
Nitơ trichloride có thể gây kích ứng màng nhầy – nó là một tác nhân gây rụng tóc, nhưng chưa bao giờ được sử dụng như vậy[4][5]. Chất tinh khiết (hiếm gặp) là chất nổ nguy hiểm, nhạy cảm với ánh sáng, nhiệt, thậm chí vừa phải sốc, và các hợp chất hữu cơ. Pierre Louis Dulong lần đầu tiên chuẩn bị nó vào năm 1812, và mất hai ngón tay và mắt trong hai vụ nổ.[6] Năm 1813, một vụ nổ NCl3 làm mù Sir Humphry Davy tạm thời, khiến ông thuê Michael Faraday làm đồng nghiệp. Cả hai người đều bị thương trong một vụ nổ NCl3 khác ngay sau đó.[7]
Tham khảo sửa
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Shaw, CA; Bains, JS (1998). “Did consumption of fluorur bleached by the agene process contribute to the incidence of neurological disease?”. Medical Hypotheses. 51 (6): 477–81. doi:10.1016/S0306-9877(98)90067-6. PMID 10052866.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (ấn bản 2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ White, G. C. (1999). The Handbook of Chlorination and Alternative Disinfectants (ấn bản 4). Wiley. tr. 322. ISBN 978-0-471-29207-4.
- ^ “Health Hazard Evaluation Report: Investigation of Employee Symptoms at an Indoor Water Park” (pdf). NIOSH eNews. National Institute for Occupational Safety and Health. 6 (4). tháng 8 năm 2008. HETA 2007-0163-3062.
- ^ Thénard J. L.; Berthollet C. L. (1813). “Report on the work of Pierre Louis Dulong”. Annales de Chimie et de Physique. 86 (6): 37–43.
- ^ Thomas, J.M. (1991). Michael Faraday and The Royal Institution: The Genius of Man and Place (PBK). CRC Press. tr. 17. ISBN 978-0-7503-0145-9.
Đọc thêm sửa
- Jander, J. (1976). “Recent Chemistry and Structure Investigation of Nitrogen Triiodide, Tribromide, Trichloride, and Related Compounds”. Advances in Inorganic Chemistry. 19: 1–63. doi:10.1016/S0065-2792(08)60070-9.
- Kovacic, P.; Lowery, M. K.; Field, K. W. (1970). “Chemistry of N-Bromamines and N-Chloramines”. Chemical Reviews. 70 (6): 639–665. doi:10.1021/cr60268a002.
- Hartl, H.; Schöner, J.; Jander, J.; Schulz, H. (1975). “Die Struktur des Festen Stickstofftrichlorids (−125 °C)”. Zeitschrift für Anorganische und Allgemeine Chemie. 413 (1): 61–71. doi:10.1002/zaac.19754130108.
- Cazzoli, G.; Favero, P. G.; Dal Borgo, A. (1974). “Molecular Structure, Nuclear Quadrupole Coupling Constant and Dipole Moment of Nitrogen Trichloride from Microwave Spectroscopy”. Journal of Molecular Spectroscopy. 50 (1–3): 82–89. doi:10.1016/0022-2852(74)90219-7.
- Bayersdorfer, L.; Engelhardt, U.; Fischer, J.; Höhne, K.; Jander, J. (1969). “Untersuchungen an Stickstoff–Chlor-Verbindungen. V. Infrarot- und RAMAN-Spektren von Stickstofftrichlorid”. Zeitschrift für Anorganische und Allgemeine Chemie. 366 (3–4): 169–179. doi:10.1002/zaac.19693660308.
Liên kết ngoài sửa
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Nitơ trichloride. |
- OSHA - Nitrogen trichloride Lưu trữ 2008-09-05 tại Wayback Machine
- Nitrogen Trichloride - Health References Lưu trữ 2013-06-19 tại Wayback Machine