Cơ chế hoạt động
Trong dược lý học, thuật ngữ cơ chế hoạt động / cơ chế tác dụng (MOA) đề cập đến tương tác sinh hóa cụ thể mà qua đó một chất dược phẩm tạo ra tác dụng dược lý của nó.[2] Một cơ chế hoạt động thường bao gồm đề cập đến các mục tiêu phân tử cụ thể mà thuốc liên kết, chẳng hạn như enzyme hoặc thụ thể.[3] Các trang web Receptor có ái lực cụ thể đối với thuốc dựa trên cấu trúc hóa học của thuốc, cũng như hành động cụ thể xảy ra ở đó. Các loại thuốc không liên kết với các thụ thể tạo ra hiệu quả điều trị tương ứng bằng cách tương tác đơn giản với các tính chất hóa học hoặc vật lý trong cơ thể. Các ví dụ phổ biến của các loại thuốc hoạt động theo cách này là thuốc kháng axit và thuốc nhuận tràng.[2]
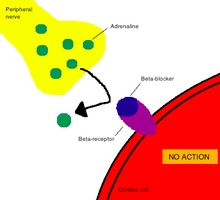
Ngược lại, một phương thức hành động (MoA) mô tả các thay đổi chức năng hoặc thay đổi mức giải phẫu ở cấp độ tế bào, do sự tiếp xúc của một sinh vật sống với một chất.
Tại sao cơ chế hoạt động lại quan trọng?
sửaLàm sáng tỏ cơ chế hoạt động của các thuốc mới là rất quan trọng vì nhiều lý do:
- Trong trường hợp phát triển thuốc chống nhiễm trùng, thông tin cho phép dự đoán các vấn đề liên quan đến an toàn lâm sàng. Các loại thuốc phá vỡ màng tế bào chất hoặc chuỗi vận chuyển điện tử, chẳng hạn, có khả năng gây ra vấn đề độc tính hơn so với các thành phần nhắm mục tiêu của thành tế bào (peptidoglycan hoặc -glucans) hoặc cấu trúc ribosome 70S, không có trong tế bào người.[4][5]
- Bằng cách biết được sự tương tác giữa một vị trí nhất định của thuốc và thụ thể, các loại thuốc khác có thể được tạo thành theo cách tái tạo sự tương tác này, do đó tạo ra hiệu quả điều trị tương tự. Thật vậy, phương pháp này được sử dụng để tạo ra các loại thuốc mới.
- Nó có thể giúp xác định bệnh nhân nào có khả năng đáp ứng với điều trị nhất. Bởi vì ung thư vú thuốc trastuzumab được biết đến để nhắm mục tiêu protein HER2, ví dụ, các khối u có thể được kiểm tra sự hiện diện của phân tử này để xác định có hay không bệnh nhân sẽ được hưởng lợi từ điều trị trastuzumab.[6][7]
- Nó có thể cho phép dùng thuốc tốt hơn vì tác dụng của thuốc trên đường đích có thể được theo dõi ở bệnh nhân. Liều dùng statin, ví dụ, thường được xác định bằng cách đo mức cholesterol trong máu của bệnh nhân.[6]
- Nó cho phép các loại thuốc được kết hợp theo cách làm giảm khả năng kháng thuốc xuất hiện. Bằng cách biết cấu trúc tế bào mà thuốc chống nhiễm trùng hoặc chống ung thư hoạt động, có thể điều trị một loại cocktail ức chế nhiều mục tiêu cùng một lúc, do đó làm giảm nguy cơ một đột biến trong DNA của vi khuẩn hoặc khối u sẽ dẫn đến kháng thuốc và thất bại điều trị.[4][8][9][10]
- Nó có thể cho phép các chỉ định khác cho thuốc được xác định. Khám phá rằng sildenafil ức chế protein phosphodiesterase-5 (PDE-5), ví dụ, cho phép thuốc này được tái sử dụng để điều trị tăng huyết áp động mạch phổi, vì PDE-5 được biểu hiện trong phổi tăng huyết áp phổi.[11][12]
Cơ chế hoạt động được xác định như thế nào
sửaPhương pháp dựa trên kính hiển vi
sửaCác hợp chất hoạt tính sinh học gây ra những thay đổi kiểu hình trong các tế bào đích, những thay đổi có thể quan sát được bằng kính hiển vi và có thể cung cấp cái nhìn sâu sắc về cơ chế hoạt động của hợp chất.[13] Với các đại lý kháng khuẩn, ví dụ, việc chuyển đổi của các tế bào mục tiêu để spheroplasts có thể là một dấu hiệu cho thấy peptidoglycan tổng hợp đang được nhắm mục tiêu, và filamentation của các tế bào mục tiêu có thể là một dấu hiệu cho thấy FtsZ hoặc DNA đang được nhắm mục tiêu.[4] Trong trường hợp tác nhân chống ung thư, sự hình thành bleb có thể là một dấu hiệu cho thấy thuốc đang phá vỡ màng plasma.[14] Một hạn chế hiện tại của phương pháp này là thời gian cần thiết để tự tạo và giải thích dữ liệu, nhưng những tiến bộ trong kính hiển vi và phần mềm phân tích hình ảnh tự động có thể giúp giải quyết vấn đề này.[4][13]
Phương pháp sinh hóa trực tiếp
sửaCác phương pháp sinh hóa trực tiếp bao gồm các phương pháp trong đó một protein hoặc một phân tử nhỏ, chẳng hạn như một ứng cử viên thuốc, được dán nhãn và được truy tìm khắp cơ thể.[15] Điều này chứng tỏ là cách tiếp cận trực tiếp nhất để tìm protein mục tiêu sẽ liên kết với các mục tiêu quan tâm nhỏ, chẳng hạn như đại diện cơ bản của phác thảo thuốc, để xác định dược điển của thuốc. Do các tương tác vật lý giữa phân tử được dán nhãn và protein, phương pháp sinh hóa có thể được sử dụng để xác định độc tính, hiệu quả và cơ chế tác dụng của thuốc.
Tham khảo
sửa- ^ Ogrodowczyk, M.; Dettlaff, K.; Jelinska, A. (2016). “Beta-blockers: Current state of knowledge and perspectives”. Mini Reviews in Medicinal Chemistry. 16 (1): 40–54. doi:10.2174/1389557515666151016125948. PMID 26471965.
- ^ a b Spratto, G.R.; Woods, A.L. (2010). Delmar Nurse's Drug Handbook. Cengage Learning. ISBN 978-1-4390-5616-5.
- ^ Grant, R.L.; Combs, A.B.; Acosta, D. (2010) "Experimental Models for the Investigation of Toxicological Mechanisms". In McQueen, C.A. Comprehensive Toxicology (2nd ed.). Oxford: Elsevier. p. 204. ISBN 978-0-08-046884-6.
- ^ a b c d Cushnie, T.P.; O'Driscoll, N.H.; Lamb, A.J. (2016). “Morphological and ultrastructural changes in bacterial cells as an indicator of antibacterial mechanism of action”. Cellular and Molecular Life Sciences. 73 (23): 4471–4492. doi:10.1007/s00018-016-2302-2. PMID 27392605.
- ^ Chang, C.C.; Slavin, M.A.; Chen, S.C. (2017). “New developments and directions in the clinical application of the echinocandins”. Archives of Toxicology. 91 (4): 1613–1621. doi:10.1007/s00204-016-1916-3. PMID 28180946.
- ^ a b No authors listed (2010). “Mechanism matters”. Nature Medicine. 16 (4): 347. doi:10.1038/nm0410-347. PMID 20376007.
- ^ Joensuu, H. (2017). “Escalating and de-escalating treatment in HER2-positive early breast cancer”. Cancer Treatment Reviews. 52: 1–11. doi:10.1016/j.ctrv.2016.11.002. PMID 27866067.
- ^ Cihlar, T.; Fordyce, M. (2016). “Current status and prospects of HIV treatment”. Current Opinion in Virology. 18: 50–56. doi:10.1016/j.coviro.2016.03.004. PMID 27023283.
- ^ Antony, H.A.; Parija, S.C. (2016). “Antimalarial drug resistance: An overview”. Tropical Parasitology. 6 (1): 30–41. doi:10.4103/2229-5070.175081. PMC 4778180. PMID 26998432.
- ^ Bozic, I.; Reiter, J.G.; Allen, B.; Antal, T.; Chatterjee, K.; Shah, P.; Moon, Y.S.; Yaqubie, A.; Kelly, N.; Le, D.T.; Lipson, E.J.; Chapman, P.B.; Diaz, L.A.; Vogelstein, B., Nowak, M.A. (2013). “Evolutionary dynamics of cancer in response to targeted combination therapy”. eLife. 2: Article ID e00747. doi:10.7554/eLife.00747. PMC 3691570. PMID 23805382.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Tari, L.; Vo, N.; Liang, S.; Patel, J.; Baral, C.; Cai, J. (2012). “Identifying novel drug indications through automated reasoning”. PLOS ONE. 7 (7): Article e40946. doi:10.1371/journal.pone.0040946. PMC 3402456. PMID 22911721.
- ^ Hayardeny, L. (2014). Why is it important to know the mode of action of drugs? (Conference presentation) (bằng tiếng Anh). New Frontiers in Neuroscience and Methods of Transdisciplinary Education Workshop, Tel Aviv University, Israel: Tel Aviv University. Truy cập ngày 18 tháng 3 năm 2017.
- ^ a b Fetz, V.; Prochnow, H.; Brönstrup, M.; Sasse, F. (2016). “Target identification by image analysis”. Natural Product Reports. 33 (5): 655–667. doi:10.1039/c5np00113g. PMID 26777141.
- ^ Dubovskii, P.V.; Vassilevski, A.A.; Kozlov, S.A.; Feofanov, A.V.; Grishin, E.V.; Efremov, R.G. (2015). “Latarcins: versatile spider venom peptides”. Cellular and Molecular Life Sciences. 72 (23): 4501–4522. doi:10.1007/s00018-015-2016-x. PMID 26286896.
- ^ Schenone, M.; Dančík, V.; Wagner, B.K.; Clemons, P.A. (2013). “Target identification and mechanism of action in chemical biology and drug discovery”. Nature Chemical Biology. 9 (4): 232–240. doi:10.1038/nchembio.1199. ISSN 1552-4450. PMC 5543995. PMID 23508189.