Cabazitaxel
Cabazitaxel (trước đây là XRP-6258, tên thương mại Jevtana) là một dẫn xuất bán tổng hợp của một loại taxoid tự nhiên.[1] Nó được phát triển bởi Sanofi-Aventis và được FDA Hoa Kỳ chấp thuận để điều trị ung thư tuyến tiền liệt nội tiết tố chịu lửa vào ngày 17 tháng 6 năm 2010. Nó là một chất ức chế vi ống, và taxan thứ tư được chấp thuận là một liệu pháp điều trị ung thư.[2] ]
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Jevtana |
| AHFS/Drugs.com | Thông tin thuốc cho người dùng |
| MedlinePlus | a611009 |
| Giấy phép |
|
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | Intravenous |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý | |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| ECHA InfoCard | 100.205.741 |
| Dữ liệu hóa lý | |
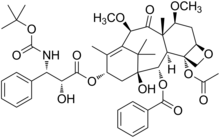
| Công thức hóa học | C45H57NO14 |
| Khối lượng phân tử | 835.93 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
[ nguồn không đáng tin cậy? Cabazitaxel kết hợp với prednison là một lựa chọn điều trị cho bệnh ung thư tuyến tiền liệt nội tiết tố chịu lửa sau khi điều trị dựa trên docetaxel.
Cơ chế hoạt động
sửaTaxanes tăng cường ổn định vi ống và ức chế quá trình nguyên phân và phân bào.[3] Hơn nữa, taxan ngăn chặn tín hiệu thụ thể androgen (AR) bằng cách liên kết các vi ống tế bào và protein dynein liên quan đến vi ống, do đó làm dịch chuyển hạt nhân AR.[4]
Các thử nghiệm lâm sàng
sửaỞ những bệnh nhân bị ung thư tuyến tiền liệt kháng thiến di căn (mCRPC), khả năng sống sót chung (HĐH) được tăng cường rõ rệt khi dùng cabazitaxel so với mitoxantrone sau khi điều trị bằng docetaxel trước đó. FIRSTANA (số nhận dạng của ClinicalTrials.gov: NCT01308567) đã đánh giá liệu cabazitaxel 20 mg/m2 (C20) hoặc 25 mg/m2 (C25) vượt trội so với docetaxel 75 mg/m2 (D75) về hệ điều hành ở bệnh nhân mCRPC chưa được hóa trị liệu. Tuy nhiên, C20 và C25 không chứng minh được sự vượt trội của HĐH so với D75 ở những bệnh nhân mắc mCRPC chưa được hóa trị liệu. Cabazitaxel và docetaxel đã chứng minh các hồ sơ độc tính khác nhau và C20 cho thấy độc tính thấp nhất.[5] Trong một thử nghiệm giai đoạn III với 755 người đàn ông để điều trị ung thư tuyến tiền liệt kháng thiến, thời gian sống trung bình là 15,1 tháng đối với bệnh nhân dùng cabazitaxel so với 12,7 tháng đối với bệnh nhân dùng mitoxantrone. Cabazitaxel có liên quan đến giảm bạch cầu trung tính cấp độ 3 (81,7%) so với mitoxantrone (58%).[6] Các tác dụng phụ thường gặp với cabazitaxel bao gồm giảm bạch cầu trung tính (bao gồm giảm bạch cầu do sốt) và tác dụng phụ của GIT xuất hiện chủ yếu ở bệnh tiêu chảy, trong khi đó, bệnh thần kinh hiếm khi được phát hiện.[7]
Dược động học
sửaQuản lý Cabazitaxel làm giảm nồng độ trong huyết tương cho thấy động lực học ba lần: thời gian bán hủy trung bình (t1/2) là 2,6 phút trong giai đoạn đầu, trung bình t1/2 của 1,3 giờ trong giai đoạn thứ hai và trung bình t1/2 của 77,3 h trong giai đoạn thứ ba.[8]
Chuyển hóa
sửaCabazitaxel về cơ bản được chuyển hóa ở gan bằng [cytochrom P450 (CYP) 3A4/5> CYP2C8], dẫn đến bảy chất chuyển hóa trong huyết tương và bài tiết 20 chất chuyển hóa. Trong 14 ngày sau khi dùng, 80% cabazitaxel được bài tiết: 76% qua phân và 3,7% dưới dạng bài tiết qua thận.[9]
Liều lượng Cabazitaxel
sửaCó nhiều câu hỏi về việc sử dụng tối ưu Cabazitaxel sau khi phê duyệt sử dụng nó trong điều trị mCRPC docetaxel chịu lửa. Một câu hỏi là về việc sử dụng tối ưu. Liên quan đến tình trạng suy tủy đáng kể trong quá trình điều trị Cabazitaxel ở tuổi 25 mg/m2, một nghiên cứu ngẫu nhiên giai đoạn III sẽ đánh giá tính an toàn và hiệu quả của cabazitaxel ở mức 20 mg/m2. Một câu hỏi nữa là về hiệu quả và khả năng dung nạp của cabazitaxel khi nó được dùng cùng với các liệu pháp khác. Một thử nghiệm giai đoạn I/II đang thử nghiệm sự phối hợp của cabazitaxel với các liệu pháp khác (ví dụ abiraterone) và các tác nhân điều tra (ví dụ như mãng cầu) [9]
Xem thêm
sửaTham khảo
sửa- ^ http://www.cancer.gov/drugdictionary/?CdrID=534131
- ^ “Jevtana (cabazitaxel) Injection Approved by U.S. FDA After Priority Review” (Thông cáo báo chí). sanofi-aventis. ngày 17 tháng 6 năm 2010. Truy cập ngày 17 tháng 6 năm 2010.
- ^ Leslie Wilson; Jordan, Mary Ann (tháng 4 năm 2004). “Microtubules as a target for anticancer drugs”. Nature Reviews Cancer. 4 (4): 253–265. doi:10.1038/nrc1317. ISSN 1474-1768.
- ^ Darshan, M. S.; Loftus, M. S.; Thadani-Mulero, M.; Levy, B. P.; Escuin, D.; Zhou, X. K.; Gjyrezi, A.; Chanel-Vos, C.; Shen, R. (ngày 15 tháng 9 năm 2011). “Taxane-Induced Blockade to Nuclear Accumulation of the Androgen Receptor Predicts Clinical Responses in Metastatic Prostate Cancer”. Cancer Research. 71 (18): 6019–6029. doi:10.1158/0008-5472.CAN-11-1417. ISSN 0008-5472. PMC 3354631.
- ^ https://ascopubs.org/doi/full/10.1200/JCO.2016.72.1068
- ^ “Cabazitaxel Effective for Hormone Refractory Prostate Cancer After Failure of Taxotere”.[liên kết hỏng]
- ^ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3063116/
- ^ Mita, A. C.; Denis, L. J.; Rowinsky, E. K.; DeBono, J. S.; Goetz, A. D.; Ochoa, L.; Forouzesh, B.; Beeram, M.; Patnaik, A. (ngày 15 tháng 1 năm 2009). “Phase I and Pharmacokinetic Study of XRP6258 (RPR 116258A), a Novel Taxane, Administered as a 1-Hour Infusion Every 3 Weeks in Patients with Advanced Solid Tumors”. Clinical Cancer Research. 15 (2): 723–730. doi:10.1158/1078-0432.CCR-08-0596. ISSN 1078-0432.
- ^ a b Tsao, Che-Kai; Cutting, Elena; Martin, Jacob; Oh, William K. (ngày 24 tháng 3 năm 2014). “The role of cabazitaxel in the treatment of metastatic castration-resistant prostate cancer”. Therapeutic Advances in Urology. 6 (3): 97–104. doi:10.1177/1756287214528557. ISSN 1756-2872. PMC 4003844.