Carfilzomib
Carfilzomib (được bán dưới tên thương mại Kyprolis, được phát triển bởi Onyx Pharmaceuticals) là một loại thuốc chống ung thư hoạt động như một chất ức chế proteasome chọn lọc. Về mặt hóa học, nó là một epoxyketone tetrapeptide và một chất tương tự epoxomicin.[2]
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Kyprolis |
| Đồng nghĩa | PX-171-007 |
| Giấy phép |
|
| Danh mục cho thai kỳ | |
| Dược đồ sử dụng | Intravenous |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Liên kết protein huyết tương | 97%[1] |
| Chuyển hóa dược phẩm | Extensive; CYP plays a minor role |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| ECHA InfoCard | 100.219.957 |
| Dữ liệu hóa lý | |
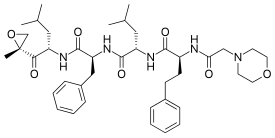
| Công thức hóa học | C40H57N5O7 |
| Khối lượng phân tử | 719.91 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt vào ngày 20 tháng 7 năm 2012 để sử dụng cho những bệnh nhân bị đa u tủy đã nhận được ít nhất hai liệu pháp trước đó, bao gồm điều trị bằng bortezomib và liệu pháp điều trị miễn dịch (như lenalidomide) và đã chứng minh tiến triển bệnh hoặc trong vòng 60 ngày kể từ khi hoàn thành liệu pháp cuối cùng. Phê duyệt ban đầu được dựa trên tỷ lệ đáp ứng.[3] Dữ liệu chứng minh lợi ích Tổng thể sống còn (HĐH) sau đó đã được thể hiện trong thử nghiệm ENDEAVOR và được FDA chấp thuận.[4]
CFZ viết tắt là phổ biến để chỉ carfilzomib, nhưng viết tắt tên thuốc không phải là thực hành tốt nhất trong y học.
Lịch sử
sửaCarfilzomib có nguồn gốc từ epoxomicin, một sản phẩm tự nhiên được phòng thí nghiệm của Craig Crews tại Đại học Yale cho thấy để ức chế proteasome.[5] Phòng thí nghiệm của phi hành đoàn sau đó đã phát minh ra một dẫn xuất cụ thể hơn của epoxomicin có tên là YU101,[6] được cấp phép cho Proteolix, Inc. Các nhà khoa học tại Proteolix đã phát minh ra một hợp chất mới, khác biệt có tiềm năng sử dụng làm thuốc ở người, được gọi là carfilzomib. Proteolix tiên tiến carfilzomib cho nhiều thử nghiệm lâm sàng giai đoạn 1 và 2, bao gồm thử nghiệm lâm sàng giai đoạn 2 được thiết kế để tìm kiếm sự chấp thuận nhanh chóng.[7] Các thử nghiệm lâm sàng đối với carfilzomib tiếp tục dưới Onyx Pharmaceuticals, công ty đã mua Proteolix vào năm 2009.[7]
Vào tháng 1 năm 2011, FDA đã cấp trạng thái theo dõi nhanh carfilzomib, cho phép Onyx bắt đầu đệ trình đơn đăng ký thuốc mới cho carfilzomib.[8] Vào tháng 12 năm 2011, FDA đã cấp chỉ định đánh giá tiêu chuẩn Onyx,[9][10] cho việc nộp đơn đăng ký thuốc mới dựa trên nghiên cứu 003-A1, một thử nghiệm 2b giai đoạn mở nhãn đơn. Thử nghiệm đã đánh giá 266 bệnh nhân được điều trị trước rất nặng với đa u tủy xương tái phát và khó chữa, người đã nhận được ít nhất hai liệu pháp trước đó, bao gồm bortezomib và thalidomide hoặc lenalidomide.[11] Nó có giá khoảng 10.000 đô la mỗi chu kỳ 28 ngày.[12]
Cơ chế
sửaCarfilzomib liên kết cộng hóa trị [13] không thể đảo ngược và ức chế hoạt động giống như chymotrypsin của proteasome 20S, một loại enzyme làm suy giảm protein tế bào không mong muốn. Carfilzomib hiển thị các tương tác tối thiểu với các mục tiêu không bảo vệ, do đó cải thiện hồ sơ an toàn trên bortezomib.[13] Ức chế sự phân giải protein qua trung gian proteasome dẫn đến sự tích tụ các protein đa lượng, có thể gây ngừng chu kỳ tế bào, apoptosis và ức chế sự phát triển của khối u.[2]
Thử nghiệm lâm sàng & tác dụng phụ
sửaĐã hoàn thành
sửaMột thử nghiệm đơn pha, giai đoạn II (003-A1) của carfilzomib ở bệnh nhân đa u nguyên bào tái phát và khúc xạ cho thấy carfilzomib đơn chất đã chứng minh tỷ lệ lợi ích lâm sàng là 36% ở 266 bệnh nhân được đánh giá và có tỷ lệ đáp ứng tổng thể là 22,9 % và thời gian trả lời trung bình là 7,8 tháng. Sự chấp thuận của FDA đối với carfilzomib dựa trên kết quả của thử nghiệm 003-A1.[14]
Trong một thử nghiệm giai đoạn II (004), carfilzomib có tỷ lệ đáp ứng tổng thể là 53% trong số những bệnh nhân bị tái phát và/hoặc đa u tủy xương trước đây chưa từng nhận bortezomib. Nghiên cứu này cũng bao gồm một đoàn hệ được điều trị bằng bortezomib. Kết quả đã được báo cáo riêng.[15] Nghiên cứu này cũng cho thấy điều trị carfilzomib kéo dài là chấp nhận được, với khoảng 22% bệnh nhân tiếp tục điều trị sau một năm. Thử nghiệm 004 là một nghiên cứu nhỏ hơn ban đầu được thiết kế để nghiên cứu tác động của điều trị carfilzomib trong mối quan hệ với điều trị bortezomib ở những bệnh nhân ít được điều trị trước (1 chế độ 3) trước đó.[16]
Một thử nghiệm giai đoạn II (005), trong đó đánh giá sự an toàn, dược động học, dược lực học và hiệu quả của carfilzomib, ở những bệnh nhân bị đa u tủy và mức độ suy thận khác nhau, trong đó gần 50% bệnh nhân đã chịu được cả bortezomib và lenalid và an toàn không bị ảnh hưởng bởi mức độ suy thận cơ bản. Carfilzomib đã được chấp nhận và chứng minh hiệu quả.[17]
Trong một thử nghiệm giai đoạn II khác (006) bệnh nhân bị tái phát và/hoặc đa u nguyên bào, carfilzomib kết hợp với lenalidomide và dexamethasone đã chứng minh tỷ lệ đáp ứng tổng thể là 69%.[18]
Một thử nghiệm giai đoạn II (007) cho đa u tủy và khối u rắn cho thấy kết quả đầy hứa hẹn.[19][20]
Trong các thử nghiệm carfilzomib giai đoạn II, các tác dụng phụ cấp 3 hoặc cao hơn phổ biến nhất là độc tính huyết học [21] với giảm tiểu cầu, thiếu máu, giảm bạch cầu, giảm bạch cầu, viêm phổi, mệt mỏi và hạ natri máu.[22]
Trong một nghiên cứu tiền tuyến giai đoạn I / II, sự kết hợp của carfilzomib, lenalidomide và dexamethasone liều thấp có hoạt tính cao và dung nạp tốt, cho phép sử dụng liều đầy đủ trong thời gian dài ở nhiều bệnh nhân u tủy mới được chẩn đoán, với nhu cầu hạn chế về liều sửa đổi. Phản hồi nhanh chóng và được cải thiện theo thời gian, đạt 100% phản hồi một phần rất tốt.[23]
Hơn nữa, rối loạn tiêu hóa, bao gồm tiêu chảy và buồn nôn là nhóm tác dụng phụ không được tạo máu thường được báo cáo với các thuốc ức chế proteasome.[21] Ngoài ra, độc tính trên tim mạch có thể là kết quả của điều trị Carfilzomib do ảnh hưởng đến proteasomes trong cơ tim.[21] Vì vậy, đánh giá bệnh nhân và đánh giá rủi ro trước khi bắt đầu điều trị bằng carfilzomib là rất quan trọng.[24]
Thử nghiệm ASPIRE
sửaMột thử nghiệm lâm sàng xác nhận giai đoạn III, được gọi là thử nghiệm ASPIRE, so sánh carfilzomib, lenalidomide và dexamethasone so với lenalidomide và dexamethasone ở những bệnh nhân bị tái phát nhiều u tủy.[25] Kết quả của nó đã được trình bày tại một cuộc họp của Hiệp hội huyết học Hoa Kỳ vào tháng 12 năm 2014. Họ chỉ ra rằng nhiều bệnh nhân đáp ứng với chế độ ba thuốc hơn đáng kể so với đáp ứng với chế độ hai thuốc.[26][27] Kết quả tạm thời của thử nghiệm ASPIRE đã được công bố trên Tạp chí Y học New England.[28]
Tham khảo
sửa- ^ “Kyprolis (carfilzomib) for Injection, for Intravenous Use. U.S. Full Prescribing Information” (PDF). Onyx Pharmaceuticals, Inc.
- ^ a b Carfilzomib, NCI Drug Dictionary
- ^ “FDA Approves Kyprolis for Some Patients with Multiple Myeloma”. FDA. ngày 20 tháng 7 năm 2012. Truy cập ngày 23 tháng 7 năm 2013.
- ^ FDA Approves Carfilzomib Label Update in Myeloma | OncLive |,
- ^ Meng, L; Mohan, R.; Kwok, B.H.; Elofsson, M.; Sin, N.; Crews, C.M. (1999). “Epoxomicin, a potent and selective proteasome inhibitor, exhibits in vivo antiinflammatory activity”. Proc Natl Acad Sci USA. 96 (18): 10403–8. doi:10.1073/pnas.96.18.10403. PMC 17900. PMID 10468620.
- ^ Myung, J; Kim, K.B.; Lindsten, K.; Dantuma, N.P.; Crews, C.M. (2001). “Lack of proteasome active site allostery as revealed by subunit-specific inhibitors”. Mol Cell. 7 (2): 411–20. doi:10.1016/S1097-2765(01)00188-5. PMID 11239469.
- ^ a b “Carfilzomib: From Discovery To Drug”. Chemical & Engineering News. ngày 27 tháng 8 năm 2012. Truy cập ngày 30 tháng 7 năm 2013.
- ^ “Onyx multiple myeloma drug wins FDA fast-track status”. San Francisco Business Times. ngày 31 tháng 1 năm 2011. Truy cập ngày 1 tháng 9 năm 2011.
- ^ “Beacon Breaking News – Carfilzomib to Get Standard, Not Priority, FDA Review”. The Myeloma Beacon. Truy cập ngày 27 tháng 2 năm 2012.
- ^ “Fast Track, Accelerated Approval and Priority Review; Accelerating Availability of New Drugs for Patients with Serious Diseases”. FDA. Truy cập ngày 27 tháng 2 năm 2012.
- ^ “PX-171-003-A1, an open-label, single-arm, phase (Ph) II study of carfilzomib (CFZ) in patients (pts) with relapsed and refractory multiple myeloma (R/R MM): Long-term follow-up and subgroup analysis”. ASCO 2011; Abstract 8027. 2011. Bản gốc lưu trữ ngày 23 tháng 3 năm 2012. Truy cập ngày 1 tháng 9 năm 2011.
- ^ “FDA Approves Kyprolis (Carfilzomib) For Relapsed And Refractory Multiple Myeloma”. The Myeloma Beacon. Truy cập ngày 20 tháng 7 năm 2012.
- ^ a b Park, Ji Eun; Park, Joonyoung; Jun, Yearin; Oh, Yunseok; Ryoo, Gongmi; Jeong, Yoo-Seong; Gadalla, Hytham H.; Min, Jee Sun; Jo, Jung Hwan (tháng 5 năm 2019). “Expanding therapeutic utility of carfilzomib for breast cancer therapy by novel albumin-coated nanocrystal formulation”. Journal of Controlled Release. 302: 148–159. doi:10.1016/j.jconrel.2019.04.006. ISSN 0168-3659. PMID 30954620.
- ^ “Carfilzomib Prescribing Information”. NCI Drug Dictionary. Truy cập ngày 23 tháng 7 năm 2013.
- ^ Vij, R (2012). “An open-label, single-arm, phase 2 study of single-agent carfilzomib in patients with relapsed and/or refractory multiple myeloma who have been previously treated with bortezomib”. Br J Haematol. 158 (6): 739–748. doi:10.1111/j.1365-2141.2012.09232.x. PMC 5818209. PMID 22845873.
- ^ Vij, R (2012). “An open-label, single-arm, phase ii (PX-171-004) study of single-agent carfilzomib in bortezomib-naive patients with relapsed and/or refractory multiple myeloma”. Blood. 119 (24): 5661–70. doi:10.1182/blood-2012-03-414359. PMC 4123327. PMID 22555973.
- ^ Badros, AZ (2013). “Carfilzomib in multiple myeloma patients with renal impairment: pharmacokinetics and safety”. Leukemia. 27 (8): 1707–14. doi:10.1038/leu.2013.29. PMC 3740399. PMID 23364621.
- ^ “European Hematology Association (EHA) 18th Congress. June 13-16, 2013”. The Myeloma Beacon. 2013. Truy cập ngày 13 tháng 7 năm 2013.
- ^ “Nikoletta Lendval, MD PhD et al. Phase II Study of Infusional Carfilzomib in Patients with Relapsed or Refractory Multiple Myeloma”. Presented at: 54th ASH Annual Meeting and Exposition: December 2012. Truy cập ngày 23 tháng 7 năm 2013.
- ^ "Phase II results of Study PX-171-007: A phase Ib/II study of carfilzomib (CFZ), a selective proteasome inhibitor, in patients with selected advanced metastatic solid tumors" - ASCO 2009; Abstract 3515.
- ^ a b c Guerrero-Garcia, Thomas A.; Gandolfi, Sara; Laubach, Jacob P.; Hideshima, Teru; Chauhan, Dharminder; Mitsiades, Constantine; Anderson, Kenneth C.; Richardson, Paul G. (ngày 14 tháng 11 năm 2018). “The power of proteasome inhibition in multiple myeloma”. Expert Review of Proteomics. 15 (12): 1033–1052. doi:10.1080/14789450.2018.1543595. ISSN 1478-9450. PMID 30427223.
- ^ “Siegel DS, Martin T, Wang, M, et al. Results of PX-171- 003-A1, an open-label, single-arm, phase 2 study of carfilzomib in patients with relapsed and refractory multiple myeloma. Presented at: 52nd ASH Annual Meeting and Exposition; December 4-7, 2010; Orlando, Florida”. OncLive.com. ngày 9 tháng 3 năm 2011. Truy cập ngày 1 tháng 9 năm 2011.
- ^ “Final Results of a Frontline Phase 1/2 Study of Carfilzomib Lenalidomide, and Low-Dose Dexamethasone (CRd) in Multiple Myeloma (MM)”. ASH 20111; Abstract 631. Truy cập ngày 27 tháng 2 năm 2012.
- ^ Efentakis, Panagiotis; Kremastiotis, Georgios; Varela, Aimilia; Nikolaou, Panagiota-Efstathia; Papanagnou, Eleni-Dimitra; Davos, Constantinos H.; Tsoumani, Maria; Agrogiannis, Georgios; Konstantinidou, Anastasia (ngày 27 tháng 11 năm 2018). “Molecular mechanisms of carfilzomib-induced cardiotoxicity in mice and the emerging cardioprotective role of metformin”. Blood. 133 (7): 710–723. doi:10.1182/blood-2018-06-858415. ISSN 0006-4971. PMID 30482794.
- ^ “Phase 3 Study Comparing Carfilzomib, Lenalidomide, and Dexamethasone (CRd) Versus Lenalidomide and Dexamethasone (Rd) in Subjects With Relapsed Multiple Myeloma”. ClinicalTrials.gov. ngày 4 tháng 8 năm 2011. Truy cập ngày 1 tháng 9 năm 2011.
- ^ Berkrot, Bill (ngày 6 tháng 12 năm 2014). “Addition of Amgen drug boosts benefits in relapsed myeloma: study”. Reuters. Bản gốc lưu trữ ngày 24 tháng 9 năm 2015. Truy cập ngày 6 tháng 12 năm 2014.
- ^ “Dr. Stewart Discusses the Efficacy of Carfilzomib in the ASPIRE Trial”. onclive. ngày 6 tháng 12 năm 2014.
- ^ Stewart, A. Keith; Rajkumar, S. Vincent; Dimopoulos, Meletios A.; và đồng nghiệp (ngày 6 tháng 12 năm 2014). “Carfilzomib, Lenalidomide, and Dexamethosone for Relapsed Multiple Myeloma”. New England Journal of Medicine. 372 (2): 142–152. doi:10.1056/NEJMoa1411321. PMID 25482145.