Phân lớp (vỏ nguyên tử)
Phân lớp electron trong bảng tuần hoàn các nguyên tố hóa học là một tập hợp các nhóm lân cận nhau.[1] Các electron năng lượng cao nhất tương ứng trong một nguyên tố trong cùng một phân lớp thì thuộc cùng một kiểm obitan nguyên tử. Mỗi phân lớp được đặt tên theo tính chất của orbitan của nó. Do đó, các phân lớp bao gồm:
- phân lớp S (chứa tối đa 2 electron)
- phân lớp P(chứa tối đa 6 electron)
- phân lớp D(chứa tối đa 10 electron)
- phân lớp F(chứa tối đa 14 electron)
- phân lớp G (giả thiết)
- phân lớp H (giả thiết)
- phân lớp I (giả thiết)
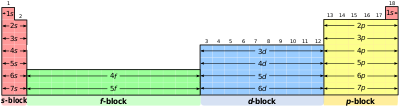
Tên phân lớp (s, p, d, f, g, h, và i) xuất phát từ ký hiệu quang phổ của obitan nguyên tử tương ứng: sharp, principal, diffuse và fundamental, và cuối cùng g,h,i theo sau ký hiệu f trong bảng chữ cái.
*Lưu ý: Khi viết cấu tạo nguyên tử của các nguyên tố tại chu kỳ 3 và 4 cần viết 4s trước 3p.
Tham khảo sửa
- ^ Charles Janet, La classification hélicoïdale des éléments chimiques, Beauvais, 1928