Phenanthrene
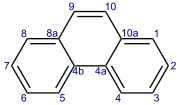
Phenanthrene là một hydrocarbon thơm đa vòng bao gồm ba vòng benzen hợp nhất. Tên 'phenanthrene' là một hỗn hợp của phenyl và anthracene. Ở dạng nguyên chất, nó được tìm thấy trong khói thuốc lá và được biết đến kích thích, nhạy cảm ánh sáng với ánh sáng. Phenanthrene hiện diện dưới dạng bột trắng có màu xanh huỳnh quang.
| Phenanthrene | |
|---|---|
 | |
 | |
 Phenanthrene | |
| Tên khác | Tricyclo[8.4.0.02,7]tetradeca-1,3,5,7,9,11,13-heptaene |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| KEGG | |
| MeSH | |
| ChEBI | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Tham chiếu Beilstein | 1905428 |
| Tham chiếu Gmelin | 28699 |
| UNII | |
| Thuộc tính | |
| Bề ngoài | Chất rắn không màu |
| Khối lượng riêng | 1.18 g/cm3[1] |
| Điểm nóng chảy | 101 °C (374 K; 214 °F)[1] |
| Điểm sôi | 332 °C (605 K; 630 °F)[1] |
| Độ hòa tan trong nước | 1.6 mg/L[1] |
| MagSus | -127.9·10−6 cm3/mol |
| Các nguy hiểm | |
| NFPA 704 |
|
| Cấu trúc | |
| Mômen lưỡng cực | 0 D |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Hợp chất có khung xương phenanthren và nitrogens ở vị trí 4 và 5 được gọi là phenanthroline.
Hóa học
sửaPhenanthren gần như không hòa tan trong nước nhưng hòa tan trong hầu hết các dung môi hữu cơ có độ phân cực thấp như toluene, carbon tetraclorua, ether, chloroform, axit axetic và benzen.
Sự tổng hợp Bardhan của Sengupta phenanthrene là một cách cổ điển để tạo ra phenanthrenes.[2]
Quá trình này bao gồm thay thế thơm điện di bằng cách sử dụng nhóm cyclohexanol buộc bằng diphospho pentoxit, đóng vòng trung tâm vào vòng thơm hiện có. Mất nước bằng cách sử dụng selen cũng chuyển đổi các vòng khác thành vòng thơm. Việc aromatization của các vòng sáu thành viên bằng selen không được hiểu rõ ràng, nhưng nó tạo ra H2Se.
Phenanthrene cũng có thể thu được quang hóa từ một số diarylethene.
Phản ứng của phenanthrene thường xảy ra ở vị trí 9 và 10, bao gồm:
- Oxy hóa hữu cơ thành phenanthrenequinone với axit thơm[3]
- Giảm hữu cơ thành 9,10-dihydrophenanthrene với khí hydro và raney niken[4]
- Halogen hóa điện thành 9-bromophenanthrene với bromine[5]
- Thải vị thơm thành 2 và các axit 3-phenanthrenesulfonic với axit sulfuric[6]
- Ozonolysis đến diphenylaldehyde[7]
Các hình thức cổ điển
sửaPhenanthren ổn định hơn so với đồng phân tuyến tính của nó anthracene. Một lời giải thích cổ điển và được thiết lập dựa trên quy tắc của Clar. Một lý thuyết mới gọi cái gọi là ổn định liên kết hydro-hydro giữa các nguyên tử hydro C4 và C5.
Ở ngoài tự nhiên
sửaRavatite là khoáng chất tự nhiên bao gồm phenanthrene.[8] Nó được tìm thấy với số lượng nhỏ trong số một vài địa điểm đốt than. Ravatite đại diện cho một nhóm nhỏ các khoáng chất hữu cơ.
Tham khảo
sửa- ^ a b c d Thông tin từ CAS-Nr. 85-01-8 trong GESTIS-Stoffdatenbank của IFA
- ^ “Bardhan Sengupta Synthesis”. Comprehensive Organic Name Reactions and Reagents. 49. 2010. tr. 215–219. doi:10.1002/9780470638859.conrr049.
- ^ Organic Syntheses, Coll. Vol. 4, p.757 (1963); Vol. 34, p.76 (1954) Link
- ^ Organic Syntheses, Coll. Vol. 4, p.313 (1963); Vol. 34, p.31 (1954) Link.
- ^ Organic Syntheses, Coll. Vol. 3, p.134 (1955); Vol. 28, p.19 (1948) Link.
- ^ Organic Syntheses, Coll. Vol. 2, p.482 (1943); Vol. 16, p.63 (1936) Link.
- ^ Organic Syntheses, Coll. Vol. 5, p.489 (1973); Vol. 41, p.41 (1961) Link.
- ^ Ravatite Mineral Data
