Retigabine
Retigabine (INN) hoặc ezogabine (USAN) là thuốc chống co giật được sử dụng như một phương pháp điều trị bổ trợ cho bệnh động kinh cục bộ ở bệnh nhân trưởng thành đã qua điều trị.[2] Thuốc được phát triển bởi Valete Pharmaceuticals và GlaxoSmithKline. Nó đã được Cơ quan Dược phẩm Châu Âu phê duyệt dưới tên thương mại Trobalt vào ngày 28 tháng 3 năm 2011 và bởi Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA), dưới tên thương mại Potiga, vào ngày 10 tháng 6 năm 2011. Việc sản xuất đã bị dừng lại vào tháng 6 năm 2017.[3][4]
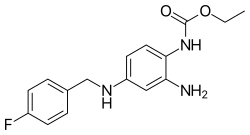 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Trobalt, Potiga |
| Đồng nghĩa | D-23129 |
| AHFS/Drugs.com | entry |
| Giấy phép | |
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | Dường uống |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý | |
| Dữ liệu dược động học | |
| Sinh khả dụng | 60% |
| Liên kết protein huyết tương | 60–80% |
| Chuyển hóa dược phẩm | Glucoronid hóa và acetyl hóa ở gan. CYP không liên quan |
| Chu kỳ bán rã sinh học | 8 giờ (trung bình), trong khoảng: 7–11 giờ[1] |
| Bài tiết | Thận (84%) |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEMBL | |
| ECHA InfoCard | 100.158.123 |
| Dữ liệu hóa lý | |
| Công thức hóa học | C16H18FN3O2 |
| Khối lượng phân tử | 303.331 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
Retigabine hoạt động chủ yếu như một dụng cụ mở kênh kali, bằng cách kích hoạt một họ kênh kali được kiểm soát điện áp nhất định trong não.[5][6][7] Cơ chế hoạt động này là duy nhất trong số các thuốc chống động kinh, và có thể hứa hẹn điều trị các tình trạng thần kinh khác, bao gồm ù tai, đau nửa đầu và đau thần kinh. Công ty đã rút retigabine khỏi việc sử dụng lâm sàng vào năm 2017.
Tác dụng phụ
sửaCác tác dụng phụ được tìm thấy trong thử nghiệm pha II chủ yếu ảnh hưởng đến hệ thần kinh trung ương và dường như liên quan đến liều dùng.[8] Các tác dụng phụ phổ biến nhất là buồn ngủ, chóng mặt, ù tai và hoa mắt, nhầm lẫn và nói chậm.[9] Các tác dụng phụ ít phổ biến hơn bao gồm run, mất trí nhớ, rối loạn dáng đi và nhìn đôi.[10] Năm 2013, FDA cảnh báo công chúng rằng, Potiga (ezogabine) có thể gây đổi màu da và bất thường mắt đặc trưng bởi sự thay đổi sắc tố ở võng mạc. FDA hiện không biết liệu những thay đổi này có thể đảo ngược hay không. FDA đang làm việc với nhà sản xuất để thu thập và đánh giá tất cả các thông tin có sẵn để hiểu rõ hơn về các sự kiện này. FDA sẽ cập nhật công khai khi có thêm thông tin.[11] Các triệu chứng tâm thần và khó tiểu cũng đã được báo cáo, với hầu hết các trường hợp xảy ra trong 2 tháng đầu điều trị.[12][13]
Tương tác
sửaRetigabine dường như không có tương tác thuốc với các thuốc chống co giật thường được sử dụng nhất. Nó có thể làm tăng chuyển hóa lamotrigine (Lamictal), trong khi phenytoin (Dilantin) và carbamazepine (CBZ, Tegretol) làm tăng độ thanh thải của retigabine.[13][14]
Sử dụng đồng thời retigabine và digoxin có thể làm tăng nồng độ trong huyết thanh sau này. Các nghiên cứu in vitro cho thấy chất chuyển hóa chính của retigabine hoạt động như một chất ức chế P-glycoprotein, và do đó có thể làm tăng sự hấp thụ và giảm đào thải digoxin.[13]
Dược lý
sửaCơ chế hoạt động
sửaRetigabine hoạt động như một chất mở kênh kali KCNQ/Kv7 thần kinh, một cơ chế hoạt động khác biệt rõ rệt so với bất kỳ thuốc chống co giật hiện nay.[5][6][7] Cơ chế hoạt động này tương tự như cơ chế flupirtine tương tự về mặt hóa học,[15] được sử dụng chủ yếu cho các đặc tính giảm đau.
Dược động học
sửaRetigabine được hấp thu nhanh chóng, và đạt nồng độ tối đa trong huyết tương từ nửa giờ đến 2 giờ sau một liều uống duy nhất. Nó có sinh khả dụng đường uống cao vừa phải (50-60%), khối lượng phân phối cao (6.2 L/ kg) và thời gian bán hủy thiết bị đầu cuối từ 8 đến 11 giờ.[14] Retigabine cần liều 3 lần mỗi ngày do thời gian bán hủy ngắn.[8][9][13]
Retigabine được chuyển hóa ở gan, bằng N - glucuronid hóa và acetyl hóa. Hệ thống cytochrom P450 không liên quan. Retigabine và các chất chuyển hóa của nó được đào thải gần như hoàn toàn (84%) qua thận.[13][14]
Lịch sử
sửaTrong số các thuốc chống co giật mới hơn, retigabine là một trong những thuốc được nghiên cứu rộng rãi nhất trong môi trường tiền lâm sàng: nó là chủ đề của hơn 100 nghiên cứu được công bố trước khi các thử nghiệm lâm sàng bắt đầu. Trong các thử nghiệm tiền lâm sàng, người ta tìm thấy có một phổ rất rộng hoạt động phúc hiệu quả trong gần như tất cả các mô hình động vật co giật và động kinh được sử dụng: retigabine ngăn chặn cơn co giật gây ra bởi sốc điện, điện củi mồi của amygdala, pentylenetetrazol, kainate, NMDA, và độc tố.[16] nhà nghiên cứu hy vọng hoạt động trên phạm vi rộng này cũng sẽ chuyển sang các nghiên cứu ở người.[8]
Các thử nghiệm lâm sàng
sửaTrong một thử nghiệm lâm sàng mù đôi, ngẫu nhiên, giả dược có đối chứng giai đoạn II, retigabine đã được thêm vào chế độ điều trị của 399 người tham gia với các cơn động kinh từng phần khó chữa khi điều trị bằng các thuốc chống động kinh khác. Tần suất xảy ra các cơn động kinh đã giảm đáng kể (từ 23 đến 35%) ở những người tham gia điều trị bằng retigabine và khoảng một phần tư đến một phần ba số người tham gia có tần suất động kinh giảm hơn 50%. Liều cao hơn có liên quan đến đáp ứng điều trị lớn hơn.[8][9][10]
Một thử nghiệm giai đoạn II có nghĩa là để đánh giá sự an toàn và hiệu quả của retigabine trong điều trị đau dây thần kinh hậu Zona đã được hoàn thành vào năm 2009, nhưng không đáp ứng được điểm cuối chính của nó. Kết quả sơ bộ đã được Valete báo cáo là "không có kết luận".[17]
Phê duyệt theo quy định
sửaCục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ đã chấp nhận Đơn đăng ký Thuốc mới của Valete cho retigabine vào ngày 30 tháng 12 năm 2009.[18] Ủy ban Tư vấn Thuốc ngoại vi và Hệ thần kinh Trung ương của FDA đã họp vào ngày 11 tháng 8 năm 2010 để thảo luận về quy trình và nhất trí khuyến nghị phê duyệt Potiga cho chỉ định dự định (điều trị bổ sung các cơn động kinh một phần ở người lớn).[19][20] Tuy nhiên, khả năng bí tiểu là một tác dụng phụ được coi là mối quan tâm đáng kể và các thành viên của hội thảo khuyến nghị nên sử dụng một số chiến lược theo dõi để xác định bệnh nhân có nguy cơ rối loạn chức năng bàng quang.[19] Potiga đã được FDA chấp thuận vào ngày 10 tháng 6 năm 2010, nhưng không có sẵn trên thị trường Hoa Kỳ cho đến khi nó được lên lịch bởi Cục Quản lý Thực thi Thuốc.[12]
Vào tháng 12 năm 2011, Cơ quan Thực thi Ma túy Hoa Kỳ (DEA) đã đưa chất này vào Đạo luật V của Đạo luật về các chất bị kiểm soát (CSA), loại chất có khả năng lạm dụng tương đối thấp. Điều này đã có hiệu lực vào ngày 15 tháng 12 năm 2011.[21]
Tên gọi
sửaCác INN "retigabine" đầu được công bố như là đang được xem xét bởi WHO vào năm 1996.[22] Điều này đã được thông qua như sau đề nghị quốc tế tên chung (Rinn) cho thuốc, và, vào năm 2005 hoặc năm 2006, Hội đồng Usan - một chương trình được tài trợ bởi Hiệp hội Y khoa Hoa Kỳ, Hội nghị Dược sĩ Hoa Kỳ và Hiệp hội Dược sĩ Hoa Kỳ chọn tên không độc quyền cho thuốc được bán tại Hoa Kỳ.[23] Tuy nhiên, vào năm 2010, Hội đồng USAN đã hủy bỏ quyết định trước đó và gán "ezogabine" làm Tên thông qua Hoa Kỳ cho loại thuốc này.[24] Do đó, loại thuốc này sẽ được gọi là "ezogabine" ở Hoa Kỳ và "retigabine" ở các nơi khác.
Tham khảo
sửa- ^ Ferron GM, Paul J, Fruncillo R, và đồng nghiệp (tháng 2 năm 2002). “Multiple-dose, linear, dose-proportional pharmacokinetics of retigabine in healthy volunteers”. Journal of Clinical Pharmacology. 42 (2): 175–82. doi:10.1177/00912700222011210. PMID 11831540.
- ^ “POTIGA (ezogabine) Tablets, CV. Full Prescribing Information” (PDF). GlaxoSmithKline and Valeant Pharmaceuticals. Revised: September, 2013. Initial U.S. Approval: 2011. Bản gốc (PDF) lưu trữ ngày 21 tháng 3 năm 2016. Truy cập ngày 4 tháng 6 năm 2014. Kiểm tra giá trị ngày tháng trong:
|date=(trợ giúp) - ^ https://assets.publishing.service.gov.uk/media/57fe4b6640f0b6713800000c/Trobalt_letter.pdf
- ^ “Epilepsy drug Trobalt (retigabine) to be discontinued”. epilepsysociety.org.uk. ngày 14 tháng 9 năm 2016. Bản gốc lưu trữ ngày 26 tháng 9 năm 2018. Truy cập ngày 5 tháng 8 năm 2019.
- ^ a b Rundfeldt C (tháng 10 năm 1997). “The new anticonvulsant retigabine (D-23129) acts as an opener of K+ channels in neuronal cells”. European Journal of Pharmacology. 336 (2–3): 243–9. doi:10.1016/S0014-2999(97)01249-1. PMID 9384239.
- ^ a b Main MJ, Cryan JE, Dupere JR, Cox B, Clare JJ, Burbidge SA (tháng 8 năm 2000). “Modulation of KCNQ2/3 potassium channels by the novel anticonvulsant retigabine”. Molecular Pharmacology. 58 (2): 253–62. doi:10.1124/mol.58.2.253. PMID 10908292.
- ^ a b Rogawski MA, Bazil CW (tháng 7 năm 2008). “New Molecular Targets for Antiepileptic Drugs: α2δ, SV2A, and Kv7/KCNQ/M Potassium Channels”. Current Neurology and Neuroscience Reports. 8 (4): 345–52. doi:10.1007/s11910-008-0053-7. PMC 2587091. PMID 18590620.
- ^ a b c d Ben-Menachem E (2007). “Retigabine: Has the Orphan Found a Home?”. Epilepsy Currents. 7 (6): 153–4. doi:10.1111/j.1535-7511.2007.00209.x. PMC 2096728. PMID 18049722.
- ^ a b c Plosker GL, Scott LJ (2006). “Retigabine: in partial seizures”. CNS Drugs. 20 (7): 601–8, discussion 609–10. doi:10.2165/00023210-200620070-00005. PMID 16800718.
- ^ a b Porter RJ, Partiot A, Sachdeo R, Nohria V, Alves WM (tháng 4 năm 2007). “Randomized, multicenter, dose-ranging trial of retigabine for partial-onset seizures”. Neurology. 68 (15): 1197–204. doi:10.1212/01.wnl.0000259034.45049.00. PMID 17420403.
- ^ “Potiga (Ezogabine): Drug Safety Communication”.
- ^ a b Hitt E (ngày 13 tháng 6 năm 2011). “FDA approves ezogabine for seizures in adults”. Medscape. Truy cập ngày 13 tháng 6 năm 2011.
- ^ a b c d e “Trobalt – Summary of Product Characteristics (SPC)”. electronic Medicines Compendium. ngày 5 tháng 5 năm 2011. Bản gốc lưu trữ ngày 6 tháng 8 năm 2017. Truy cập ngày 13 tháng 6 năm 2011.
- ^ a b c Łuszczki JJ (2009). “Third-generation antiepileptic drugs: mechanisms of action, pharmacokinetics and interactions” (PDF). Pharmacology Reports. 61 (2): 197–216. doi:10.1016/s1734-1140(09)70024-6. PMID 19443931.
- ^ Brown, DA; Passmore, GM (2009). “Neural KCNQ (Kv7) channels”. British Journal of Pharmacology. 156 (8): 1185–95. doi:10.1111/j.1476-5381.2009.00111.x. PMC 2697739. PMID 19298256.
- ^ Rogawski MA (tháng 6 năm 2006). “Diverse Mechanisms of Antiepileptic Drugs in the Development Pipeline”. Epilepsy Research. 69 (3): 273–94. doi:10.1016/j.eplepsyres.2006.02.004. PMC 1562526. PMID 16621450.
- ^ “Valeant Pharmaceuticals Announces Preliminary Results From Its Phase IIa Retigabine Study for the Treatment of Postherpetic Neuralgia (PHN)” (Thông cáo báo chí). PRNewswire. ngày 24 tháng 8 năm 2009. Truy cập ngày 13 tháng 6 năm 2011.
- ^ “Retigabine NDA accepted for filing” (Thông cáo báo chí). PRNewswire. ngày 30 tháng 12 năm 2009. Truy cập ngày 19 tháng 7 năm 2010.
- ^ a b Lowry F (ngày 12 tháng 8 năm 2010). “Epilepsy drug exogabine gets green light from FDA Advisory Panel”. Medscape. Truy cập ngày 13 tháng 8 năm 2010.
- ^ [No authors listed] (ngày 25 tháng 6 năm 2010). “ngày 11 tháng 8 năm 2010: Peripheral and Central Nervous System Drugs Advisory Committee Meeting Announcement”. U.S. Food and Drug Administration. Truy cập ngày 19 tháng 7 năm 2010.
- ^ U.S. Drug Enforcement Administration (ngày 15 tháng 12 năm 2011). “Schedules of Controlled Substances: Placement of Ezogabine Into Schedule V” (PDF). Federal Register. 76 (241).
- ^ World Health Organization (1996). “International Nonproprietary Names for Pharmaceutical Substances (INN). Proposed INN: List 76” (PDF). WHO Drug Information. 10 (4): 215. Bản gốc (PDF) lưu trữ ngày 19 tháng 2 năm 2012. Truy cập ngày 5 tháng 8 năm 2019.
- ^ [No authors listed] (2005–06). “Statement on a nonproprietary name adopted by the USAN council: Retigabine” (PDF). American Medical Association. Truy cập ngày 19 tháng 7 năm 2010. Kiểm tra giá trị ngày tháng trong:
|year=(trợ giúp) - ^ [No authors listed] (2010). “Statement on a nonproprietary name adopted by the USAN council: Ezogabine” (PDF). American Medical Association. Lưu trữ bản gốc ngày 2 tháng 4 năm 2012. Truy cập ngày 19 tháng 7 năm 2010.Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
Đọc thêm
sửa- Flupirtine
- Blackburn-Munro G, Dalby-Brown W, Mirza NR, Mikkelsen JD, Blackburn-Munro RE (2005). “Retigabine: chemical synthesis to clinical application”. CNS Drug Rev. 11 (1): 1–20. doi:10.1111/j.1527-3458.2005.tb00033.x. PMID 15867950.
- Hempel R, Schupke H, McNeilly PJ, và đồng nghiệp (tháng 5 năm 1999). “Metabolism of retigabine (D-23129), a novel anticonvulsant”. Drug Metab Dispos. 27 (5): 613–22. PMID 10220491.
Liên kết ngoài
sửa- Dược phẩm quốc tế Valete: Đường ống thần kinh Lưu trữ 2010-08-01 tại Wayback Machine
- Học viện não trẻ em Miami - Retigabine Lưu trữ 2012-05-30 tại Wayback Machine