Dendrotoxin
Dendrotoxins là một nhóm các chất tiền sinh neurotoxin được sản xuất bởi các loài rắn mamba (Dendroaspis) chặn các phân nhóm cụ thể của gated điện áp kênh kali trong nơ-ron, do đó tăng cường giải phóng acetylcholine tại mối nối thần kinh cơ. Do hiệu lực và tính chọn lọc cao đối với các kênh kali, dendrotoxin đã được chứng minh là cực kỳ hữu ích vì là công cụ dược lý để nghiên cứu cấu trúc và chức năng của các kênh ion protein.
Tác dụng chức năng trong hệ thần kinh
sửaDendrotoxin đã được chứng minh là có thể ngăn chặn các phân nhóm cụ thể của kali bị kiểm soát các kênh điện áp (K+) trong mô thần kinh.[cần dẫn nguồn] Trong hệ thần kinh, các kênh K+ điện áp kiểm soát tính dễ bị kích thích của dây thần kinh và cơ bằng cách kiểm soát điện thế màng nghỉ và bằng tái cực màng trong điện thế hành động. Dendrotoxin đã được chứng minh là liên kết nút của Ranvier của tế bào thần kinh vận động[1] và để chặn hoạt động của các kênh kali này. Theo cách này, dendrotoxin kéo dài thời gian của tiềm năng tác dụng và tăng giải phóng acetylcholine tại ngã ba thần kinh cơ, có thể dẫn đến giảm khả năng gây suy nhược cơ và các triệu chứng co giật.
Cấu trúc Dendrotoxin
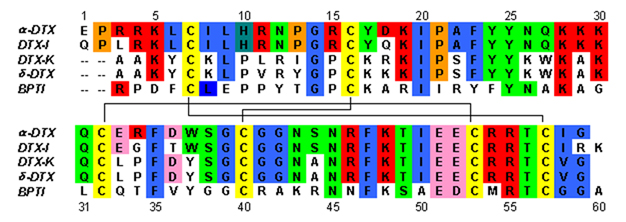
sửaDendrotoxin là ~ 7kDa protein bao gồm một chuỗi peptide duy nhất khoảng 57-60 amino acid. Một số tương đồng của alpha-dendrotoxin đã được phân lập, tất cả đều sở hữu một trình tự hơi khác nhau. Tuy nhiên, kiến trúc phân tử và cấu trúc gấp của các protein này đều rất giống nhau. Dendrotoxin sở hữu rất ngắn 310-helix gần N-terminus của peptide, trong khi hai lượt alpha-helix xảy ra gần C-terminator. Một antiparallel hai sợi -sheet chiếm phần trung tâm của cấu trúc phân tử. Hai sợi này được kết nối bởi một vùng-méo [2] đó được cho là quan trọng đối với hoạt động liên kết của protein. Tất cả các dendrotoxin được liên kết chéo bởi ba cầu disulfide, giúp tăng tính ổn định cho protein và đóng góp rất lớn vào cấu trúc cấu trúc của nó. Dư lượng cysteine hình thành các liên kết disulfide này đã được bảo tồn trong số tất cả các thành viên của họ dendrotoxin, và được đặt tại C7-C57, C16-C40 và C32-C53 (đánh số theo alpha-dendrotoxin).
Các dendrotoxin có cấu trúc tương đồng với Kunitz - loại chất ức chế protease serine, bao gồm chất ức chế trypsin tuyến tụy (BPTI). Alpha-dendrotoxin và BPTI đã được chứng minh là có 35% danh tính trình tự cũng như các liên kết disulfide giống hệt nhau. Mặc dù có sự tương đồng về cấu trúc giữa hai loại protein này, nhưng dendrotoxin dường như không thể hiện bất kỳ hoạt động protease ức chế có thể đo lường nào như BPTI. Sự mất hoạt động này dường như là kết quả của việc không có dư lượng amino acid chính tạo ra sự khác biệt về cấu trúc gây cản trở các tương tác chính cần thiết cho hoạt động protease được thấy trong BPTI.
Dendrotoxin là các protein cơ bản có lưới điện tích dương khi có trong trung tính pH. Hầu hết các dư lượng amino acid tích điện dương của dendrotoxin nằm ở phần dưới của cấu trúc, tạo ra một miền ic cation ở một bên của protein. Kết quả điện tích dương từ dư lượng lysine (Lys) và arginine (Arg) tập trung ở ba vùng chính của protein: gần đầu N (Arg3, Arg4, Lys5), gần C- bến cuối (Arg54, Arg55) và tại khu vực quay β vòng hẹp (Lys28, Lys29, Lys30).[3] Người ta tin rằng các dư lượng tích điện dương này có thể đóng một vai trò quan trọng trong hoạt động liên kết dendrotoxin, vì chúng có thể tạo ra các tương tác tiềm năng với các vị trí anion (amino acid tích điện âm) trong lỗ chân lông của các kênh kali.
Tham khảo
sửa- ^ Gasparini S, Danse J-M, Licoq A, Pinkasfeld S, Zinn-Justin S, Young LC, C.L. de Medeiros C, Rowan EG, Harvey AL, and Me’nez A (1998). Delineation of the Functional Site of alpha-dendrotoxin: The functional topographies of dendrotoxins are different but share a conserved core with those of other KV1 potassium channel-blocking toxins. J Biol Chem 273:25393-25403
- ^ Katoh E, Nishio H, Inui T, Nishiuchi Y, Kimura T, Sakakibara S, Yamazaki T (2000). Structural Basis for the Biological Activity of Dendrotoxin-I, a Potent Potassium Channel Blocker. Biopolymers 54:44-57
- ^ Swaminathan P, Hariharan M, Murali R, Singh CU (1996). Molecular Structure, Conformational Analysis, and Structure-Activity Studies of Dendrotoxin and Its Homologues Using Molecular Mechanics and Molecular Dynamics Techniques. J Med Chem. 39:2141-2155