Vanadi(III) chloride
Vanadi(III) chloride là hợp chất vô cơ có công thức hóa học VCl3. Muối màu tím này là tiền thân phổ biến của các phức hợp vanadi(III) khác.[2]
| Vanadi(III) chloride | |
|---|---|
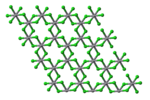 Cấu trúc của vanadi(III) chloride | |
| Danh pháp IUPAC | Vanadium(III) chloride Vanadium trichloride |
| Tên khác | Vanadơ chloride Vanadi trichloride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số RTECS | YW2800000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| Thuộc tính | |
| Công thức phân tử | VCl3 |
| Khối lượng mol | 157,2991 g/mol (khan) 265,39078 g/mol (6 nước) |
| Bề ngoài | tinh thể tím thuận từ (khan) tinh thể lục (6 nước) |
| Khối lượng riêng | 3 g/cm³ (20 ℃) |
| Điểm nóng chảy | > 300 °C (573 K; 572 °F) (phân hủy) |
| Điểm sôi | |
| Độ hòa tan trong nước | tan |
| MagSus | +3030,0·10-6 cm³/mol |
| Cấu trúc | |
| Cấu trúc tinh thể | Trigonal, hR24 |
| Nhóm không gian | R-3, No. 148 |
| Các nguy hiểm | |
| Nguy hiểm chính | độ độc cao |
| Điểm bắt lửa | không bắt lửa |
| Ký hiệu GHS |   [1] [1] |
| Báo hiệu GHS | Nguy hiểm[1] |
| Chỉ dẫn nguy hiểm GHS | H302, H314[1] |
| Chỉ dẫn phòng ngừa GHS | P280, P305, P310, P338, P351[1] |
| Các hợp chất liên quan | |
| Anion khác | Vanadi(III) fluoride Vanadi(III) sulfide Vanadi(III) bromide |
| Cation khác | Titan(III) chloride Crom(III) chloride Niobi(III) chloride Tantan(III) chloride |
| Hợp chất liên quan | Vanadi(II) chloride Vanadi(IV) chloride |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Cấu trúc
sửaVCl3 có cấu trúc BiI3 phổ biến, một mô-típ có khung chloride với dạng lục giác gần nhất và các ion vanadi chiếm các lỗ bát diện. VBr3 và VI3 có cùng một cấu trúc, nhưng VF3 có cấu trúc giống hơn so với ReO3. VCl3 có tính thuận từ và có hai electron chưa ghép cặp.
Điều chế và phản ứng
sửaVCl3 được điều chế bằng cách làm nóng VCl4 tại 160–170 °C (320–338 °F; 433–443 K) dưới dòng khí trơ, tạo ra Cl2. Chất lỏng màu đỏ tươi chuyển thành chất rắn màu tím.
Làm nóng VCl3 thì chất phân hủy kèm theo sự bay hơi VCl4, để lại VCl2.[3] Khi đun nóng với H2 ở 675 °C (1.247 °F; 948 K) đến dưới 700 °C (1.292 °F; 973 K), VCl3 bị khử thành chất rắn màu xanh lục VCl2.
- 2VCl3 + H2 → 2VCl2 + 2HCl
Sự kết hợp của vanadi(III) chloride và vanadi(V) oxit với vanadyl trichloride tạo ra vanadyl đichloride:[4]
- V2O5 + VOCl3 + 3VCl3 → 6VOCl2
Vanadi(III) chloride xúc tác phản ứng ghép pinacol của benzaldehyd (PhCHO) thành 1,2-điphenyl-1,2-etanđiol bằng nhiều kim loại khử khác nhau như kẽm:[5]
- Zn + 2H2O + 2PhCHO → (PhCH(OH))2 + Zn(OH)2
Phức hợp
sửaVCl3 hình thành các dẫn xuất đầy màu sắc với quy mô rộng của các phối tử. VCl3 hòa tan trong nước để tạo ra hexahydrat, nhưng công thức cấu tạo trước đây chưa được rõ. Muối được mô tả theo công thức [VCl2(H2O)4]Cl.2H2O. Nói cách khác, hai trong số các phân tử nước không liên kết với vanadi, có cấu trúc giống với dẫn xuất Fe(III) tương ứng. Loại bỏ hai phối tử chloride liên kết khỏi [VCl2(H2O)4]+ trong dung dịch nước cho ion xanh lục [V(H2O)6]3+.[6]
Với tetrahydrofuran, VCl3 tạo thành chất rắn đỏ hồng VCl3(THF)3.[8] Với acetonitril, người ta thu được chất rắn lục VCl3(MeCN)3.
Khi được xử lý bằng KCN, VCl3 chuyển thành V(CN)74−. Thông thường các kim loại thường tạo số phối trí cao (hơn 6) với các phối tử nhỏ gọn. Ngoài ra, các kim loại lớn hơn có thể tạo thành phức chất với các phối tử khá cồng kềnh. Nó được minh họa bằng sự cô lập của VCl3(NMe3)2, chứa hai phối tử NMe3 cồng kềnh.
Tiền thân của hợp chất hữu cơ
sửaChất có tính phản ứng V(mesityl)3 hình thành từ VCl3(THF)3.[9]
- VCl3(THF)3 + 3LiC6H2-2,4,6-Me3 → V(C6H2-2,4,6-Me3)3(THF) + 3LiCl
Hợp chất khác
sửaTham khảo
sửa- ^ a b c d “Vanadium(III) Chloride SDS”. American Elements. Truy cập ngày 17 tháng 8 năm 2018.
- ^ Holleman, A. F.; Wiberg, E. Inorganic Chemistry Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ Young, R. C.; Smith, M. E. "Vanadium(III) Chloride" Inorganic Syntheses volume IV, tr. 128–130, 1953. doi:10.1002/9780470132357.ch43
- ^ G. Brauer (1963). “Vanadium Oxydichloride”. Trong G. Brauer (biên tập). Handbook of Preparative Inorganic Chemistry, 2nd Ed. NY: Academic Press. tr. 1263.
- ^ Vanadium-Catalyzed Pinacol Coupling Reaction in Water Xiaoliang Xu and Toshikazu Hirao J. Org. Chem.; 2005; 70(21) pp 8594–96. doi:10.1021/jo051213f
- ^ Donovan, W. F.; Smith, P. W. "Crystal and Molecular Structures of Aquahalogenovanadium(III) Complexes. Part 1. X-Ray Crystal Structure of trans-Tetrakisaquadibromovanadium(III) Bromide Dihydrate and the lsomorphous Chloro-compound" Journal of the Chemical Society, Dalton Transactions. 1975, pages 894-896. doi:10.1039/DT9750000894
- ^ F.A.Cotton, S.A.Duraj, G.L.Powell, W.J.Roth (1986). “Comparative Structural Studies of the First Row Early Transition Metal(III) Chloride Tetrahydrofuran Solvates”. Inorg. Chim. Acta. 113: 81. doi:10.1016/S0020-1693(00)86863-2.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Manzer, L. E. "Tetrahydrofuran Complexes of Selected Early Transition Metals," Inorganic Synthesis. 21, 135–140, (1982).
- ^ Vivanco, M.; Ruiz, J.; Floriani, C.; Chiesi-Villa, A.; Rizzoli, C. "Chemistry of the vanadium-carbon.sigma. bond. 1. Insertion of carbon monoxide, isocyanides, carbon dioxide, and heterocumulenes into the V-C bond of Tris(mesityl)vanadium(III)" Organometallics 1993 volume 12, 1794–1801. doi:10.1021/om00029a042
- ^ Zeitschrift für Naturforschung: Astrophysik, Physik und physikalische Chemie. Abteilung A., Tập 24 (Verlag der Zeitschrift für Naturforschung, 1969), trang 127 – [1]. Truy cập 22 tháng 5 năm 2020.