Amide
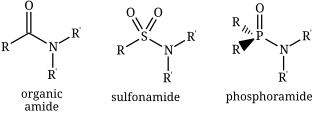
Một amide (/ˈæmaɪd/ hoặc /ˈæmɪd/ hoặc /ˈeɪmaɪd/),[1][2][3] cũng được biết đến như một acid amide, là một hợp chất với các nhóm chức RnE(O)xNR′2 (R và R' là các nhóm H hoặc nhóm hữu cơ). Phổ biến nhất là carboxamide (hữu cơ amide) (n = 1, E = C x = 1), nhưng nhiều loại amide khác quan trọng được biết đến, bao gồm cả phosphoramide (n = 2, E = P x = 1 và rất nhiều công thức liên quan) và sulfonamide (E = S, x = 2).[4] Thuật ngữ amide đề cập cả đến các nhóm của các hợp chất và các nhóm chức (RnE(O)xNR'2) trong những hợp chất trên.
Amide có thể còn đề cập đến acid liên hợp của Amonia (các cation H2N−) hay của một amine hữu cơ (một cation R2N−).
Cấu trúc và liên kết
sửaAmide đơn giản nhất là các dẫn xuất của Amonia trong đó một nguyên tử hydro đã được thay thế bằng một nhóm acyl. Cấu trúc này thường được mô tả đại diện như RC(O)NH2 và được mô tả như một amide chính. Liên quan chặt chẽ và nhiều hơn nữa là các amide thứ sinh có thể được bắt nguồn từ các amin chính (R′NH2) và có công thức RC(O)NHR′. Các amide bậc ba thường có nguồn gốc từ các amin thứ cấp (R′R″NH) và có cấu trúc chung là RC(O)NR′R″. Amide thường được coi là dẫn xuất của các acid carboxylic trong đó nhóm hydroxyl bị thay thế bằng một amin hoặc amonia.
Cặp electron đơn độc của nitơ được ghép vào nhóm carbonyl, và tạo ra một liên kết đôi một phần giữa N và carbonyl carbon. Do đó, ni tơ trong amide không phải là hình chóp. Người ta ước tính rằng acetamide được mô tả bởi cấu trúc cộng hưởng A cho 62% và của B là 28% (không bằng 100% bởi vì có các hình cộng hưởng bổ sung không được mô tả trong hình trên).[5]
Danh mục
sửaTheo cách đặt tên danh mục thông thường, người ta thêm từ "amid" vào gốc của tên của acid mẹ. Ví dụ, amide bắt nguồn từ acid acetic is được gọi là acetamide (CH3CONH2). IUPAC đề nghị tên ethanamid, nhưng tên chính thức và các tên liên quan này hiếm khi gặp phải. Khi amide có nguồn gốc từ amin bậc nhất hoặc thứ cấp, các gốc thế trên nitơ được chỉ ra trước tiên trong tên. Do đó, amide hình thành từ dimethylamin và acid acetic là N,N-dimethylacetamide (CH3CONMe2, trong đó Me = CH3). Thông thường ngay cả tên này cũng được đơn giản hóa thành dimethylacetamide. Các amide vòng được gọi là lactam; chúng nhất thiết là amide bậc 2 hoặc bậc ba. Các nhóm chức năng bao gồm –P(O)NR2 và –SO2NR2 tương ứng là phosphonamide và sulfonamid.[6]
Tính chất
sửaTính base
sửaSo sánh với amin, các amide là các base rất yếu.. Trong khi acid liên hợp của một amin có pKa khoảng 9.5, acid liên hợp của amide chỉ có pKa vào khoảng −0.5. Do đó, các amide không có đặc tính acid-base rõ ràng trong nước. Sự thiếu hụt tương đối của tính base này được giải thích bằng tính hút electron của nhóm carbonyl nơi mà cặp electron đơn lẻ trên nitơ bị trục xuất do cộng hưởng. Mặt khác, amide là các base mạnh hơn nhiều so với acid carboxylic, ester, Aldehyde, và ceton (các acid liên hợp của chúng có pKas từ −6 đến −10). Mô phỏng trên máy tính cho thấy acetamide được biểu diễn bởi cấu trúc cộng hưởng A cho 62% và bởi B cho 28%. Phần lớn cộng hưởng được ngăn ngừa trong quinuclidone bị giới hạn.
Do sự gia tăng oxy điện của oxy, nên carbonyl (C=O) là một lưỡng cực mạnh hơn lưỡng cực N–C. Sự hiện diện của lưỡng cực C=O và, đến một mức độ thấp hơn, lưỡng cực N–C cho phép các amide hoạt động như các chất chấp nhận liên kết hydro. Trong các amide sơ cấp và bậc 2, sự hiện diện của lưỡng cực N–H cho phép các amide có chức năng như các nhà cung cấp liên kết hydro. Do đó các amide có thể tham gia liên kết hydro với nước và các dung môi tiên tiến khác; nguyên tử oxy có thể chấp nhận các liên kết hydro từ nước và các nguyên tử hydro N-H có thể hiến tặng các liên kết hydro. Do những tương tác như vậy, độ tan trong nước của amide lớn hơn so với các hydrocarbon tương ứng.
Proton của amide nguyên sinh hoặc thứ cấp không tách rời dễ dàng trong điều kiện bình thường; chỉ số pKa của nó thường cao hơn 15. Ngược lại, trong điều kiện cực kỳ acid, oxy carbonyl có thể nhận proton với pKa gần bằng −1.
Hòa tan
sửaĐộ hòa tan của các amide và este là khá tương đồng. Thường amide ít tan hơn khi so sánh với amin và acid carboxylic vì các hợp chất này có thể vừa tặng vừa chấp nhận các liên kết hydro. Amide bậc ba, với ngoại lệ quan trọng của N,N-dimethylformamide có độ hòa tan thấp trong nước.
Phản ứng
sửa- Amide có thể tham gia phản ứng thủy phân(polyamide/ protein)
*Protein -> Amino acid
Phản ứng thủy phân amide đôi khi ko được mong muốn vì nó có thể phá huỷ vật liệu.
- Amide có thể bị khử thành amine
Thông thường, chất xúc tác được sử dụng là liti nhôm hydride trong phòng thí nghiệm. Nhưng trong công nghiệp người ta hay dùng niken do liên kết đôi giữa carbon và oxy khá bền vũng. Điều kiện để phản ứng xảy ra hiệu quả là trên 200 độ C, áp suất trên 200 atm.
Chú thích
sửa- ^ “Amide definition and meaning Collins English Dictionary”. Truy cập 8 tháng 5 năm 2018.
- ^ Bản mẫu:AHDict
- ^ “amide Definition of amide in English by Oxford Dictionaries”. Oxford Dictionaries English. Bản gốc lưu trữ ngày 2 tháng 4 năm 2015. Truy cập 8 tháng 5 năm 2018.
- ^ IUPAC, Compendium of Chemical Terminology (Giản lược thuật ngữ hoá học), bản thứ 2 ("Gold Book") (1997). Bản đã chỉnh sửa trực tuyến: (2006–) "amides". doi:10.1351/goldbook.A00266
- ^ Kemnitz, Carl R.; Loewen, Mark J. (1 tháng 3 năm 2007). “"Amide Resonance" Correlates with a Breadth of C−N Rotation Barriers”. Journal of the American Chemical Society (bằng tiếng Anh). 129 (9): 2521–2528. doi:10.1021/ja0663024. ISSN 0002-7863.
- ^ Organic Chemistry IUPAC Nomenclature. Rules C-821. Amides http://www.acdlabs.com/iupac/nomenclature/79/r79_540.htm
Liên kết
sửa- Tổng hợp amide (phản ứng ghép cặp) – Scác giao thức tổng hợp Lưu trữ 2013-10-26 tại Wayback Machine từ organic-reaction.com
- IUPAC Compendium of Chemical Terminology