Bạc sulfat
(Đổi hướng từ Bạc sunfat)
Bạc(I) sulfat (công thức hóa học: Ag2SO4) là một hợp chất ion bạc được sử dụng trong mạ bạc, là chất thay thế cho bạc(I) nitrat. Muối sulfat này khá bền ở điều kiện sử dụng và lưu trữ bình thường tuy chúng bị tối màu đi khi tiếp xúc với ánh sáng và không khí. Bạc(I) sulfat ít tan trong nước.
| Bạc sulfat | |
|---|---|
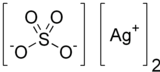 Công thức cấu tạo của bạc sulfat | |
 Mẫu bạc(I) sulfat | |
| Danh pháp IUPAC | Silver sulfate |
| Tên khác | Disilver sulfate |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| UNII | |
| Thuộc tính | |
| Công thức phân tử | Ag2SO4 |
| Khối lượng mol | 311,7996 g/mol |
| Bề ngoài | Tinh thể không màu |
| Mùi | Không mùi |
| Khối lượng riêng | 5,45 g/cm³ (25 ℃) 4,84 g/cm³ (660 ℃)[1] |
| Điểm nóng chảy | 652,2–660 °C (925,4–933,1 K; 1.206,0–1.220,0 °F)[1][2] |
| Điểm sôi | 1.085 °C (1.358 K; 1.985 °F)[3][2] |
| Độ hòa tan trong nước | 0,57 g/100 mL (0 ℃) 0,69 g/100 mL (10 ℃) 0,83 g/100 mL (25 ℃) 0,96 g/100 mL (40 ℃) 1,33 g/100 mL (100 ℃)[4], xem thêm bảng độ tan |
| Tích số tan, Ksp | 1,2·10-5[1] |
| Độ hòa tan | Tan trong dung dịch axit, cồn, aceton, ete, acetat, amit[4] Không tan trong EtOH và HF[3] tạo phức với amonia |
| Độ hòa tan trong axit sulfuric | 8,4498 g/L (0,1 molH2SO4/LH2O)[4] 25,44 g/100 g (13 ℃) 31,56 g/100 g (24,5 ℃) 127,01 g/100 g (96 ℃)[3] |
| Độ hòa tan trong etanol | 7,109 g/L (0,5 nEtOH/H2O)[4] |
| Độ hòa tan trong axit acetic | 7,857 g/L (0,5 nAcOH/H2O)[4] |
| MagSus | -9,29·10-5 cm³/mol[1] |
| Chiết suất (nD) | nα = 1,756 nβ = 1,775 nγ = 1,782[5] |
| Cấu trúc | |
| Cấu trúc tinh thể | Trực thoi, oF56[5] |
| Nhóm không gian | Fddd, No. 70[5] |
| Hằng số mạng | a = 10,2699(5) Å, b = 12,7069(7) Å, c = 5,8181(3) Å[5] |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH | -715,9 kJ/mol[1] |
| Entropy mol tiêu chuẩn S | 200,4 kJ/mol[1] |
| Nhiệt dung | 131,4 J/mol·K[1] |
| Các nguy hiểm | |
| NFPA 704 |
|
| Ký hiệu GHS |   [6] [6] |
| Báo hiệu GHS | Nguy hiểm |
| Chỉ dẫn nguy hiểm GHS | H318, H410[6] |
| Chỉ dẫn phòng ngừa GHS | P273, P280, P305+P351+P338, P501[6] |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Điều chế
sửaBạc(I) sulfat được điều chế bằng cách cho acid sulfuric vào dung dịch bạc(I) nitrat:
Từ AgHSO4 thu được:
- 2AgHSO4 (dd) ⇌ Ag2SO4 (r) + H2SO4 (dd)
Hợp chất khác
sửaAg2SO4 còn tạo một số hợp chất với NH3, như Ag2SO4·4NH3 là tinh thể không màu.[7]
Xem thêm
sửaTham khảo
sửa- ^ a b c d e f g Lide, David R. biên tập (2009). CRC Handbook of Chemistry and Physics . Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b “MSDS of Silver sulfate”. https://www.fishersci.ca. Fisher Scientific, Inc. Truy cập ngày 19 tháng 7 năm 2014. Liên kết ngoài trong
|website=(trợ giúp) - ^ a b c Anatolievich, Kiper Ruslan. “silver sulfate”. http://chemister.ru. Truy cập ngày 19 tháng 7 năm 2014. Liên kết ngoài trong
|website=(trợ giúp) - ^ a b c d e Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (ấn bản 2). New York: D. Van Nostrand Company. tr. 622–623.
- ^ a b c d Morris, Marlene C.; McMurdie, Howard F.; Evans, Eloise H.; Paretzkin, Boris; Groot, Johan H. de; Hubbard, Camden R.; Carmel, Simon J. (tháng 6 năm 1976). “13”. Standard X-ray Diffraction Powder Patterns. 25. Washington: Institute for Materials Research National Bureau of Standards.
- ^ a b c Bản dữ liệu Bạc sulfat của Sigma-Aldrich, truy cập lúc {{{Datum}}} (PDF).
- ^ Zeitschrift für Naturforschung: Physik, physikalische Chemie, Kosmophysik. Teil A, Tập 34,Phần 1,Trang 1-786 (Verlag der Zeitschrift für Naturforschung, 1979), trang 333. Truy cập 15 tháng 4 năm 2021.
