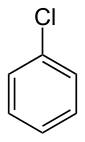
Chlorobenzen
Chlorobenzen là một hợp chất hữu cơ thơm với công thức hóa học C6H5Cl. Chất lỏng không màu dễ cháy này là một dung môi thông thường và được sử dụng rộng rãi trong quá trình sản xuất các hóa chất khác.[3]
| Chlorobenzen | |||
|---|---|---|---|
| |||
 | |||
| Danh pháp IUPAC | chlorobenzene | ||
| Tên khác | benzene chloride monochlorobenzene Phenyl chloride Chlorobenzol MCB | ||
| Nhận dạng | |||
| Viết tắt | PhCl | ||
| Số CAS | |||
| PubChem | |||
| KEGG | |||
| ChEBI | |||
| ChEMBL | |||
| Số RTECS | CZ0175000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| UNII | |||
| Thuộc tính | |||
| Công thức phân tử | C6H5Cl | ||
| Khối lượng mol | 112.56 g/mol | ||
| Bề ngoài | colorless liquid | ||
| Mùi | almond-like[1] | ||
| Khối lượng riêng | 1.11 g/cm³, liquid | ||
| Điểm nóng chảy | −45 °C (228 K; −49 °F) | ||
| Điểm sôi | 131 °C (404 K; 268 °F) | ||
| Độ hòa tan trong nước | 0.5 g l−1 trong nước at 20 °C | ||
| Độ hòa tan trong các dung môi khác | hòa tan trong most organic solvents | ||
| Áp suất hơi | 9 mmHg[1] | ||
| MagSus | -69.97·10−6 cm³/mol | ||
| Các nguy hiểm | |||
| NFPA 704 |
| ||
| Chỉ dẫn R | R10 R20 R51/53 | ||
| Chỉ dẫn S | S24/25 S61 | ||
| Giới hạn nổ | 1.3%-9.6%[1] | ||
| PEL | TWA 75 ppm (350 mg/m³)[1] | ||
| LD50 | 2290 mg/kg (đường miệng, chuột) 2250 mg/kg (rabbit, oral) 2300 mg/kg (mouse, oral) 2250 mg/kg (guinea pig, oral)[2] | ||
| REL | none[1] | ||
| IDLH | 1000 ppm[1] | ||
| Các hợp chất liên quan | |||
| Nhóm chức liên quan | Fluorobenzen Bromobenzen Iodobenzen | ||
| Hợp chất liên quan | benzen 1,4-dichlorobenzen | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Ứng dụng
sửaLịch sử
sửaỨng dụng chính của chlorobenzen là chất trung gian trong sản xuất các hàng hoá như thuốc diệt cỏ, thuốc nhuộm và cao su. Chlorobenzen cũng được sử dụng như một dung môi có nhiệt độ sôi cao trong nhiều ứng dụng công nghiệp cũng như trong phòng thí nghiệm.[4] Chlorobenzen được nitrat hóa ở quy mô lớn để tạo ra hỗn hợp 2-nitrochlorobenzene và 4-nitrochlorobenzene, sau đó chúng được tách ra. Các mononitrochlorobenzene này được chuyển đổi thành 2-nitrophenol, 2-nitroanisole, bis (2-nitrophenyl) disulfua, và 2-nitroaniline do phản ứng thế ái nhân của gốc chloride, tương ứng là natri hydroxide, natri metoxide, natri disulfua, và amonia. Các chuyển đổi của các dẫn xuất 4-nitro cũng diễn ra tương tự.[5]
Chlorobenzen đã từng được sử dụng trong quá trình sản xuất một số thuốc trừ sâu, đáng kể nhất là DDT, bằng phản ứng với chloral (trichloroacetaldehyde), nhưng ứng dụng này đã giảm khi DDT bị hạn chế sử dụng. Vào một thời điểm, chlorrobenzen là tiền chất cho quá trình sản xuất phenol:[6]
- C6H5Cl + NaOH → C6H5OH + NaCl
- Sản phẩm phụ của phản ứng này là muối ăn.
Sản xuất
sửaChất này được mô tả lần đầu tiên vào năm 1851. Chlorobenzen được sản xuất bằng cách chlor hóa benzen với sự có mặt của một acid Lewis làm xúc tác, như sắt(III) chloride, sulfur dichloride, và nhôm chloride:[3]
Chất xúc tác làm tăng mức độ ái điện tử của chất chlor. Vì chlor có độ điện âm, C6H5Cl giảm mức độ phản ứng đối với việc chlor hoá thêm nữa. Về công nghiệp, phản ứng được tiến hành như một quá trình liên tục để giảm thiểu sự hình thành các dichlorrobenzen.
Trong phòng thí nghiệm
sửaChlorobenzen có thể được sản xuất từ anilin thông qua benzenediazonium chloride, phương pháp này được gọi là phản ứng Sandmeyer.
An toàn
sửaChlorobenzen có độc tính thấp đến vừa phải với chỉ số LD50 là 2.9 g/kg. Cơ quan an toàn và sức khoẻ nghề nghiệp Hoa Kỳ đã thiết lập một giới hạn cho phép tiếp xúc tại 75 ppm (350 mg/m³) trong thời gian trung bình 8 giờ đối với công nhân xử lý chlorrobenzen.[7]
Tham khảo
sửa- ^ a b c d e f “NIOSH Pocket Guide to Chemical Hazards #0121”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ “Chlorobenzene”. Nguy hiểm ngay lập tức đến tính mạng hoặc sức khỏe. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ a b U. Beck, E. Löser "Chlorinated Benzenes and other Nucleus-Chlorinated Aromatic Hydrocarbons" Ullmann's Encychlorpedia of Industrial Chemistry, 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.o06_o03
- ^ Rossberg, Manfred; Lendle, Wilhelm; Pfleiderer, Gerhard; Tögel, Adolf; Dreher, Eberhard-Ludwig; Langer, Ernst; Rassaerts, Heinz; Kleinschmidt, Peter; Strack, Heinz; Cook, Richard; Beck, Uwe; Lipper, Karl-August; Torkelson, Theodore R.; Löser, Eckhard; Beutel, Klaus K.; Mann, Trevor (2006). “Ullmann's Encychlorpedia of Industrial Chemistry - Chlorinated Hydrocarbons”. doi:10.1002/14356007.a06_233.pub2. ISBN 3527306730. Chú thích journal cần
|journal=(trợ giúp);|chapter=bị bỏ qua (trợ giúp) - ^ Booth, Gerald (2000). “Ullmann's Encychlorpedia of Industrial Chemistry - Nitro Compounds, Aromatic”. doi:10.1002/14356007.a17_411. ISBN 3527306730. Chú thích journal cần
|journal=(trợ giúp);|chapter=bị bỏ qua (trợ giúp) - ^ Weber, Manfred; Weber, Markus; Kleine-Boymann, Michael (2004). “Ullmann's Encychlorpedia of Industrial Chemistry - Phenol”. doi:10.1002/14356007.a19_299.pub2. ISBN 3527306730. Chú thích journal cần
|journal=(trợ giúp);|chapter=bị bỏ qua (trợ giúp) - ^ CDC - NIOSH Pocket Guide to Chemical Hazards