Rubidi perchlorat
Hợp chất vô cơ
Rubidi perchlorat (công thức hóa học: RbClO4), là muối perchlorat của rubidi. Nó là một chất oxy hóa mạnh như tất cả các hợp chất perchlorat khác.
| Rubidi perchlorat | |
|---|---|
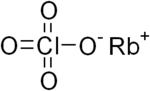 | |
| Danh pháp IUPAC | Rubidium perchlorate |
| Tên khác | Perchloric acid rubidium salt, Rubidium chlorate(VII), Rubidii perchloras (lat.) |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| Thuộc tính | |
| Công thức phân tử | RbClO4[1] |
| Khối lượng mol | 184.918 g/mol |
| Bề ngoài | tinh thể trong suốt |
| Khối lượng riêng | 2.878 g/cm³ 2.71 g/cm³ over 279 °C |
| Điểm nóng chảy | 281 °C (554 K; 538 °F) |
| Điểm sôi | 600 °C (873 K; 1.112 °F) (phân hủy) |
| Độ hòa tan trong nước | xem bảng |
| Tích số tan, Ksp | 3×10−3[2] |
| Các nguy hiểm | |
| NFPA 704 |
|
| Ký hiệu GHS |   [3] [3] |
| Báo hiệu GHS | Warning |
| Chỉ dẫn nguy hiểm GHS | H272, H302, H315, H319, H332, H335 |
| Chỉ dẫn phòng ngừa GHS | P210, P220, P221, P261, P264, P270, P271, P280, P301+P312, P302+P352, P304+P312, P304+P340, P305+P351+P338, P312, P321, P330, P332+P313, P337+P313, P362, P370+P378, P403+P233, P405 |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Tổng hợp và tính chất
sửaRubidi perchlorat có thể thu được thông qua việc đun nóng dung dịch rubidi chlorat[4]:
- 2RbClO 3 → RbClO4 + RbCl + O2
Khi đun nóng, nó phân hủy thành rubidi chloride và khí oxy[5]:
- RbClO4 → RbCl + 2O2
Bảng độ tan của rubidi perchlorat trong nước[3]:
| Nhiệt độ (°C) | 0 | 8.5 | 14 | 20 | 25 | 50 | 70 | 99 |
|---|---|---|---|---|---|---|---|---|
| Độ hòa tan (g/100 ml) | 1.09 | 0.59 | 0.767 | 0.999 | 1.30 | 3.442 | 6.72 | 17.39 |
Tham khảo
sửa- ^ “Rubidium perchlorate”. Lưu trữ bản gốc ngày 21 tháng 11 năm 2021. Truy cập ngày 21 tháng 11 năm 2021.
- ^ John Rumble (18 tháng 6 năm 2018). CRC Handbook of Chemistry and Physics (bằng tiếng Anh) (ấn bản 99). CRC Press. tr. 5-189. ISBN 1138561630.
- ^ a b F. Brezina, J. Mollin, R. Pastorek, Z. Sindelar. Chemicke tabulky anorganickych sloucenin (Chemical tables of inorganic compounds). SNTL, 1986.
- ^ Abegg, R.; Auerbach, F. (1908). Handbuch der anorganischen Chemie. 2. S. Hirzel. tr. 431.
- ^ d' Ans, Jean; Lax, Ellen (1997). Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale. 3 (ấn bản 4). Berlin: Springer. tr. 686. ISBN 3-540-60035-3. OCLC 312750698.
Liên kết ngoài
sửa- MSDS at Science Lab Lưu trữ 2010-01-02 tại Wayback Machine
