Thành viên:TRAN Thi Thuan (UU)/TRAN Thi Thuan (UU)
Phản ứng alkene hóa Peterson ( hay còn gọi là phản ứng Peterson ) là phản ứng hóa học của các α-silyl carbanion với keton (hoặc aldehyde ) để hình thành β-hydroxysilan, hợp chất này sau đó bị khử để tạo thành anken. [1]
Một số bài báo đã được công bố. [2] [3] [4] [5] [6]
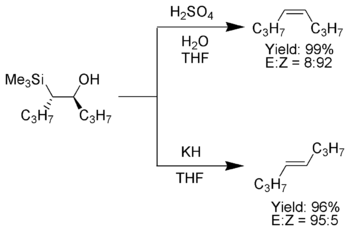
Tính năng hấp dẫn của phản ứng alkene hóa Peterson là nó có thể được sử dụng để điều chế cả cis -và trans-alkenes từ cùng một beta-hydroxysilane. Sự khử beta-hydroxysilane bằng acid sẽ mang lại một alkene, trong khi sự khử của cùng một beta-hydroxysilane với bazơ, sẽ mang lại một alkene với cấu hình lập thể đối lập.
Sự khử bằng Bazơ
sửaHành động của bazơ trên beta-hydroxysilane (1) dẫn đến sự khử syn (2) hoặc (3) để tạo thành những mong muốn alkene. Silicate trung gian với năm cấu tử xung quanh (3) được giả định, nhưng không có bằng chứng tồn tại đến ngày. [khi nào?]]
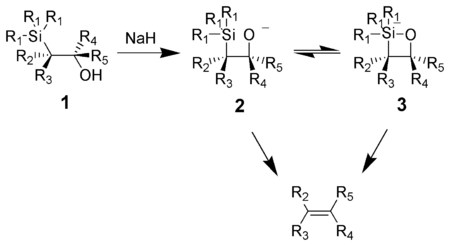
Kali alkoxides khử nhanh chóng, trong khi natri alkoxides thường yêu cầu nhiệt độ. Magiê alkoxides chỉ khử trong điều kiện khắc nghiệt. Khả năng phản ứng của alkoxides đựoc sắp xếp theo trình tự, K > Na >> Mg, điều này phù hợp với mật độ điện tử cao trên oxy, do đó tăng alkoxide nucleophilicity.
Sự khử bằng acid
sửaSự điều trị của beta-hydroxysilane (1) với acid dẫn đến quá trình proton và sự khử anti để tạo thành những alkene mong muốn .

Nhóm thế alkyl
sửaKhi alpha-silyl carbanion chỉ chứa alkyl, hydrogen, hoặc nhóm thế tăng điẹn tử, hóa học lập thể của phản ứng alkene hóa Peterson có thể kiểm soát được, bởi vì ở nhiệt độ thấp sự khử diễn ra chậm và trung gian beta-hydroxysilane có thể được cô lập.
Một khi bị cô lập, những đồng phân diastereomeric beta-hydroxysilanes đựoc tách ra. Một diastereomer được xủ lý với acid, trong khi đồng phân còn lại được xử lý với bazơ, do đó có thể chuyển hóa chất nền ban đầu để thành alkene với cấu hình lập thể mong muốn.[4]
Các nhóm thế rút electron
sửaKhi alpha-silyl carbanion chứa nhóm thế rút electron, Peterson olefination sẽ ngay lập tức hình thành alkene. Trung gian beta-hydroxysilane không thể được cô lập bởi vì nó bị khử ngay lạp tức. Sự khử bằng bazơ đã được tiên đoán trong các trường hợp này.
Các biến thể
sửaSự khử bằng acid đôi khi không khả thi bởi vì acid cũng thúc đẩy quá trình đồng phân hóa nối đôi. Ngoài ra, sự khử dụng natri hoặc kali hydride có thể không khả thi bởi vì sự không tương thích với các nhóm chức. Chan et al. đã tìm thấy rằng acylation của silylcarbinol trung gian với acetyl clorua hoặc thionyl clorua cho một beta-silyl ester đó sẽ bị khử ngay lập tức ở 25 °C để tạo ra những alkene mong muốn.[7] Corey và đồng nghiệp phát triển một phương pháp (đôi khi được gọi là sự Corey-Peterson olefination[8]) sử dụng một silylated imine để tạo ra một alpha,beta-không bão hòa aldehyde từ carbonyll trong một bước.[9] Cho một ví dụ cho việc sử dụng nó trong tổng hợp xem: Kuwajima Taxol tổng hợp
Xem thêm
sửa- House–Wadsworth–Nó phản ứng
- Tebbe olefination
- Wittig phản ứng
Tài liệu tham khảo
sửa
- ^ D. J. Peterson (1968). “Carbonyl olefination reaction using silyl-substituted organometallic compounds”. J. Org. Chem. 33 (2): 780–784. doi:10.1021/jo01266a061.
- ^ Birkofer, L.; Stiehl, O. Top. Curr. Chem. 1980, 88, 58. (Review)
- ^ Ager, D. J. Synthesis 1984, 384–398. (Review)
- ^ a b Ager, D. J. Org. React. 1990, 38, 1. doi:10.1002/0471264180.or038.01
- ^ T. H. Chan (1977). “Alkene synthesis via β-functionalized organosilicon compounds”. Acc. Chem. Res. 10 (12): 442–448. doi:10.1021/ar50120a003.
- ^ New developments in the Peterson olefination reaction L. Frances van Staden, David Gravestock and David J. Ager Chem. Soc. Rev., 2002,31, 195-200 doi:10.1039/A908402I
- ^ T. H. Chan; E. Chang (1974). “Synthesis of alkenes from carbonyl compounds and carbanions alpha to silicon. III. Full report and a synthesis of the sex pheromone of gypsy moth”. J. Org. Chem. 39 (22): 3264–3268. doi:10.1021/jo00936a020. PMID 4473100.
- ^ X. Zeng; F. Zeng; E. Negishi (2004). “Efficient and Selective Synthesis of 6,7-Dehydrostipiamide via Zr-Catalyzed Asymmetric Carboalumination and Pd-Catalyzed Cross-Coupling of Organozincs”. Org. Lett. 6 (19): 3245–3248. doi:10.1021/ol048905v. PMID 15355023.
- ^ E. J. Corey; D. Enders; M. G. Bock (1976). “A simple and highly effective route to α-β-unsaturated aldehydes”. Tetrahedron Letters. 17 (1): 7–10. doi:10.1016/S0040-4039(00)71308-6.