Cuban
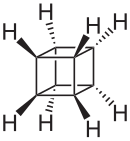
Cubane (C8H8) là một phân tử hydrocarbon tổng hợp bao gồm tám nguyên tử carbon được sắp xếp ở các góc của khối lập phương, với một nguyên tử hydro được gắn vào mỗi nguyên tử carbon. Là một chất kết tinh rắn, cubane là một trong những hydrocarbon Platonic và là thành viên của prismanes. Nó được tổng hợp lần đầu tiên vào năm 1964 bởi Philip Eaton và Thomas Cole.[2] Trước công trình này, các nhà nghiên cứu tin rằng các phân tử dựa trên carbon khối sẽ không ổn định để tồn tại. Hình dạng khối đòi hỏi các nguyên tử carbon phải có góc liên kết 90 ° sắc nét khác thường, sẽ rất căng so với góc 109,45 °Của carbon tứ diện. Sau khi hình thành, cubane khá ổn định về mặt động lực học, do thiếu các đường phân hủy có sẵn. Nó là hydrocarbon đơn giản nhất với đối xứng bát diện.
| Cubane | |||
|---|---|---|---|
| |||
| Tên hệ thống | Pentacyclo[4.2.0.02,5.03,8.04,7]octane | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| ChEBI | |||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| Thuộc tính | |||
| Công thức phân tử | C8H8 | ||
| Khối lượng mol | 104,15 g/mol | ||
| Khối lượng riêng | 1,29 g/cm³ | ||
| Điểm nóng chảy | 133,5 °C (406,6 K; 272,3 °F)[1] | ||
| Điểm sôi | 161,6 °C (434,8 K; 322,9 °F)[1] | ||
| Các hợp chất liên quan | |||
| Nhóm chức liên quan | Cuneane Dodecahedrane Tetrahedrane Prismane Prismane C8 | ||
| Hợp chất liên quan | Heptanitrocubane Octanitrocubane Octaazacubane | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Có năng lượng cao nhưng ổn định động lực học làm cho cubane và các hợp chất phái sinh của nó hữu ích cho việc lưu trữ năng lượng được kiểm soát. Ví dụ, octanitrocubane và heptanitrocubane đã được nghiên cứu là chất nổ hiệu suất cao.
Các hợp chất này thường có khối lượng riêng rất cao cho các phân tử hydrocarbon. Mật độ năng lượng cao có nghĩa là một lượng lớn năng lượng có thể được lưu trữ trong một không gian tương đối nhỏ, một sự cân nhắc quan trọng cho các ứng dụng trong lưu trữ nhiên liệu và vận chuyển năng lượng.
Tổng hợp
sửaSự tổng hợp cổ điển năm 1964 bắt đầu bằng việc chuyển đổi 2-cyclopentenone thành 2-bromo cyclopentadienone:[2][3]
Phản ứng brom hóa allylic với <i id="mwKQ">N</i> -bromosuccinimide trong carbon tetrachloride, sau đó bổ sung brom phân tử vào anken tạo ra 2,3,4-tribromocyclopentanone. Xử lý hợp chất này bằng diethylamine trong dietyl ete gây ra việc loại bỏ hai chất tương đương hydro bromide để tạo ra sản phẩm diene.
Việc xây dựng các khuôn khổ cubane 8-carbon bắt đầu khi 2 bromocyclopentadienone trải qua một tự phát Diels-Alder dimerization, tương tự như dimerization của cyclopentadiene để dicyclopentadiene -2 phân tử của 1 phản ứng để tạo thành 2. Đối với các bước tiếp theo để thành công, chỉ có đồng phân endo là hữu ích và đây là đồng phân chiếm ưu thế được hình thành trong phản ứng này. Đây là sản phẩm rất có thể là kết quả của sự tương tác steric tối thiểu giữa brom của mỗi phân tử với brom và carbonyl của các chất khác khi các chất phản ứng tiếp cận nhau và giảm thiểu tương tác lưỡng cực trong trạng thái chuyển tiếp của chính phản ứng. Cả hai nhóm carbonyl đều được bảo vệ dưới dạng acetal với ethylene glycol và <i id="mwRg">p</i> -toluenesulfonic trong benzen; một acetal sau đó được khử chọn lọc bằng dung dịch axit clohydric thành 3.
Trong bước tiếp theo, các endo đồng phân 3 (với cả hai anken nhóm gần) hình thành nên lồng giống như đồng phân 4 trong một quang [2 + 2] cycloaddition. Nhóm bromoketone được chuyển đổi thành axit cacboxylic 5 ký hợp đồng vòng trong sắp xếp lại Favourskii với kali hydroxide. Tiếp theo, quá trình khử carboxyl nhiệt diễn ra thông qua axit chloride (với thionyl chloride) và tert-butyl perester 6 (với tert-butyl hydroperoxit và pyridine) đến 7; Sau đó, acetal được loại bỏ một lần nữa trong 8. Một sự sắp xếp lại Favourskii thứ hai cho 9, và cuối cùng một decarboxylation khác đưa ra, thông qua 10, cubane (11).
Các dẫn xuất
sửaSự tổng hợp các dẫn xuất octaphenyl từ tetraenylcyclobutadiene niken bromide của Freedman vào năm 1962 trước ngày phát hiện hợp chất gốc. Nó là một hợp chất không màu hòa tan ít tan chảy ở 425 °C.[1][4][5][6] Một hypercubane, với cấu trúc giống như hypercube, được dự đoán sẽ tồn tại trong một ấn phẩm năm 2014.[7][8] Hai đồng phân khác nhau của cubene đã được tổng hợp và một phần ba được phân tích tính toán. Các anken trong ortho -cubene có khả năng phản ứng đặc biệt do hình dạng hình chóp của nó. Tại thời điểm tổng hợp, đây là anken hình chóp nhất đã được chế tạo thành công.[9] Đồng phân meta -cubene thậm chí còn kém bền hơn và đồng phân para -cubene có lẽ chỉ tồn tại dưới dạng liên kết chứ không phải là liên kết chéo thực tế.[10]
Phản ứng
sửaCuneane có thể được sản xuất từ cubane bằng cách sắp xếp lại liên kết liên kết kim loại ion [11][12]
Xem thêm
sửa- Basketane
- Hypercubane
- Octanitrocubane
- Heptanitrocubane
Tham khảo
sửa- ^ a b c Biegasiewicz, Kyle; Griffiths, Justin; Savage, G. Paul; Tsanakstidis, John; Priefer, Ronny (2015). "Cubane: 50 years later". Chemical Reviews. 115: 6719–6745. doi:10.1021/cr500523x. PMID 26102302. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “Biegasiewicz” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ a b Eaton, Philip E.; Cole, Thomas W. (1964). "Cubane". J. Am. Chem. Soc. 86 (15): 3157–3158. doi:10.1021/ja01069a041. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “eaton-1964” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ Eaton, Philip E.; Cole, Thomas W. (1964). "The Cubane System". J. Am. Chem. Soc. 86 (5): 962–964. doi:10.1021/ja01059a072. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “eaton1964” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ Freedman, H. H. (1961). "Tetraphenylcyclobutadiene Derivatives. II.1 Chemical Evidence for the Triplet State". J. Am. Chem. Soc. 83 (9): 2195–2196. doi:10.1021/ja01470a037. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “freedman1961” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ Freedman, H. H.; Petersen, D. R. (1962). "Tetraphenylcyclobutadiene Derivatives. IV.1 "Octaphenylcubane"; A Dimer of Tetraphenylcyclobutadiene". J. Am. Chem. Soc. 84 (14): 2837–2838. doi:10.1021/ja00873a046. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “freedman1962” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ Pawley, G. S.; Lipscomb, W. N.; Freedman, H. H. (1964). "Structure of the Dimer of tetraphenylcyclobutadiene". J. Am. Chem. Soc. 86 (21): 4725–4726. doi:10.1021/ja01075a042. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “freedman1965” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ Pichierri, F. (2014). “Hypercubane: DFT-based prediction of an Oh-symmetric double-shell hydrocarbon”. Chem. Phys. Lett. 612: 198–202. doi:10.1016/j.cplett.2014.08.032.
- ^ http://www.compchemhighlights.org/2014/12/hypercubane-dft-based-prediction-of-oh.html
- ^ Eaton, Philip E.; Maggini, Michele (1988). “Cubene (1,2-dehydrocubane)”. J. Am. Chem. Soc. 110 (21): 7230–7232. doi:10.1021/ja00229a057.
- ^ Minyaev, Ruslan M.; Minkin, Vladimir I.; Gribanova, Tatyana N. (2009). “2.3 A Theoretical Approach to the Study and Design of Prismane Systems”. Trong Dodziuk, Helena (biên tập). Strained Hydrocarbons. Wiley. tr. 55. ISBN 9783527627141.
- ^ Smith, Michael B.; March, Jerry (2001). March’s Advanced Organic Chemistry (5th ed.). John Wiley & Sons. p. 1459. ISBN 0-471-58589-0. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “March” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ Kindler, K.; Lührs, K. (1966). "Studien über den Mechanismus chemischer Reaktionen, XXIII. Hydrierungen von Nitrilen unter Verwendung von Terpenen als Wasserstoffdonatoren". Chem. Ber. 99: 227–232. doi:10.1002/cber.19660990135. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “kindler” được định rõ nhiều lần, mỗi lần có nội dung khác