Sulfuryl chloride
Sulfuryl chloride là một hợp chất vô cơ có công thức hóa học SO2Cl2. Ở nhiệt độ phòng, nó là chất lỏng không màu có mùi hăng. Sulfuryl chloride không có trong tự nhiên, vì nó thủy phân nhanh chóng.
| Sulfuryl chloride | |
|---|---|
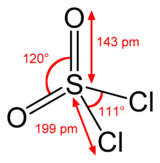 Cấu trúc và kích thước của sulfuryl chloride | |
 Mô hình bóng và gậy của sulfuryl chloride | |
 | |
| Danh pháp IUPAC | Sulfuryl chloride |
| Tên khác | Sulfonyl chloride Sulfuric chloride Sulfur dichloride dioxide |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| ChEBI | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | SO2Cl2 |
| Khối lượng mol | 134,9698 g mol−1 |
| Bề ngoài | Chất lỏng không màu có mùi hăng. Ngả vàng khi để lâu. |
| Khối lượng riêng | 1,67 g cm−3 (20 °C) |
| Điểm nóng chảy | −54,1 °C (219,1 K; −65,4 °F) |
| Điểm sôi | 69,4 °C (342,5 K; 156,9 °F) |
| Độ hòa tan trong nước | Thủy phân |
| Độ hòa tan | Trộn lẫn với benzen, toluen, chloroform, CCl4, acid acetic băng. |
| Chiết suất (nD) | 1,4437 (20 °C)[1] |
| Các nguy hiểm | |
| Phân loại của EU | Ăn mòn (C) |
| NFPA 704 |
|
| Chỉ dẫn R | R14, R34, R37 |
| Chỉ dẫn S | (S1/2), S26, Bản mẫu:S30, S45 |
| Điểm bắt lửa | Không bắt lửa |
| Các hợp chất liên quan | |
| Nhóm chức liên quan | Sulfuryl fluoride |
| Hợp chất liên quan | Thionyl chloride Acid chlorosulfonic acid sulfuric |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Sulfuryl chloride thường bị nhầm lẫn với thionyl chloride, SOCl2. Tính chất của hai lưu huỳnh oxychloride này khá khác nhau: sulfuryl chloride là một nguồn chlor trong khi thionyl chloride là nguồn ion chloride. Tên IUPAC khác của nó là sulfuroyl dichloride.
Cấu trúc
sửaCác nguyên tử lưu huỳnh kết nối tứ diện trong SO2Cl2, gắn vào hai nguyên tử oxy bằng liên kết đôi phân cực (mà không dùng đến orbital d[2]) và gắn vào hai nguyên tử clo bằng liên kết đơn phân cực. Trạng thái oxy hóa của nguyên tử lưu huỳnh là +6, giống như ở axit sulfuric.
Tổng hợp
sửaSO2Cl2 được tổng hợp bằng phản ứng giữa lưu huỳnh dioxide và chlor với xúc tác, như than hoạt tính.
- SO2 + Cl2 → SO2Cl2
Sản phẩm thô có thể được tinh chế bằng cách chưng cất phân đoạn. Người ta ít khi tổng hợp SO2Cl2 trong phòng thí nghiệm vì nó có bán sẵn ngoài thị trường. Sulfuryl chloride cũng có thể được coi là dẫn xuất của acid sulfuric.[3]
Sulfuryl chloride lần đầu tiên được nhà hóa học người Pháp Henri Victor Regnault điều chế vào năm 1838.[4]
Phản ứng
sửaSulfuryl chloride phản ứng với nước, tạo ra khí hydro chloride và acid sulfuric:
- 2 H2O + SO2Cl2 → 2 HCl + H2SO4
SO2Cl2 cũng sẽ phân hủy khi bị nung nóng tới nhiệt độ 100 °C, 30 °C trên nhiệt độ sôi của nó.
Khi để lâu SO2Cl2 phân hủy thành lưu huỳnh dioxide và chlor, khiến cho khí cũ ngả sang màu hơi vàng.
Sử dụng
sửaSulfuryl chloride thường được sử dụng làm nguồn cung cấp khí clo Cl2. Do là chất lỏng có thể rót được nên người ta coi nó là thuận tiện hơn Cl2 khi đo đạc, lưu giữ và pha chế. SO2Cl2 được sử dụng rộng rãi làm chất phản ứng trong chuyển hóa C−H thành C−Cl gần các thành phần hoạt tính như các carbonyl và sulfoxide. Nó cũng clo hóa các alkan, alken, alkyn, hợp chất thơm, ether (như tetrahydrofuran) và epoxide. Các phản ứng như vậy diễn ra trong các điều kiện gốc tự do sử dụng một chất mồi như AIBN. Nó cũng được sử dụng để chuyển hóa các thiol hay disulfide thành các sulfenyl chloride tương ứng của chúng, mặc dù các sulfinyl chloride được tạo ra từ thiol trong một số trường hợp.[5] SO2Cl2 cũng có thể chuyển hóa các alcohol thành alkyl chloride. Trong công nghiệp, sulfuryl chloride được sử dụng chủ yếu trong sản xuất thuốc trừ sâu. SO2Cl2 cũng có thể dùng trong xử lý len để ngăn co rút.
An toàn
sửaSO2Cl2 có độc tính, gây ăn mòn, và có thể dùng làm chất xịt hơi cay. Nó có thể tạo thành hỗn hợp bốc khói với nước, cũng như các dung môi donor như dimethyl sulfoxide và dimethylformamide.
Sách tham khảo
sửa- “Sulfuryl chloride CAS No.: 7791-25-5” (PDF). OECD SIDS. UNEP Publications. 2004. Bản gốc (pdf) lưu trữ ngày 28 tháng 2 năm 2007. Truy cập ngày 21 tháng 9 năm 2017.
- Maynard, G. D. (2001). “Sulfuryl Chloride”. Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rs140.
Đọc thêm
sửa- Lautens, M.; Bouchain, G. (2002). “[4+3] Cycloaddition in Water. Synthesis of 2,4-endo,endo-Dimethyl-8-Oxabicyclo[3.2.1]oct-6-en-3-one”. Organic Syntheses. 79: 251.; Collective Volume, 10, tr. 336
- McKee, R. H.; Salls, C. M. (1924). “Sulfuryl Chloride”. Industrial and Engineering Chemistry. 16 (4): 351–353. doi:10.1021/ie50172a008.
- Moussa, V. N. (2012). “Sulfuryl Chloride: A Versatile Alternative to Chlorine”. Australian Journal of Chemistry. 65 (1): 95–96. doi:10.1071/CH11367.
Tham khảo
sửa- ^ Patnaik, P. (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8.[cần số trang]
- ^ Cunningham, T. P.; Cooper, D. L.; Gerratt, J.; Karadakov, P. B.; Raimondi, M. (1997). “Chemical bonding in oxofluorides of hypercoordinate sulfur”. Journal of the Chemical Society, Faraday Transactions. 93 (13): 2247–2254. doi:10.1039/A700708F.
- ^ Hogan, C. M. (2011). “Sulfur”. Trong Jorgensen, A.; Cleveland, C. J. (biên tập). Encyclopedia of Earth. Washington, DC: National Council for Science and the Environment.
- ^ Regnault, Victor (1838). “Sur l'acide chlorosulfurique et la sulfamide” [On sulfuryl chloride and sulfamide]. Annales de chimie et de physique, séries 2 (bằng tiếng Pháp). 69: 170–184.
- Bản in lại: Regnault, Victor (1839). “Ueber die Chlorschwefelsäure und das Sulfamid” [On sulfuryl chloride and sulfamide]. Journal für Praktische Chemie (bằng tiếng Đức). 18: 93–104.
- ^ Page, P. C. B.; Wilkes, R. D.; Reynolds, D. (1995). “Alkyl Chalcogenides: Sulfur-based Functional Groups”. Trong Ley, Steven V. (biên tập). Synthesis: Carbon with One Heteroatom Attached by a Single Bond. Comprehensive Organic Functional Group Transformations. Elsevier. tr. 113–276. ISBN 9780080423234.
