Thủy ngân(II) nitrat
Thủy ngân(II) nitrat là một muối tinh thể không màu và có độc, tan trong nước của thủy ngân(II) và axit nitric. Nó được dùng để xử lý lông thú để tạo thành nỉ trong một quá trình có tên gọi 'carroting'. Cụm từ "điên như một người đội mũ" có liên quan đến bệnh tâm thần do việc tiếp xúc quá nhiều với thủy ngân(II) nitrat. Việc sử dụng chất này tiếp tục ở Hoa Kỳ cho đến khi nó được Bộ Dịch vụ Y tế Công cộng Hoa Kỳ cấm vào tháng 12 năm 1941. Mặc dù điều này có vẻ mang lại lợi ích cho sức khoẻ, lệnh cấm thực sự đã cho phép thủy ngân(II) nitrat được sử dụng rộng rãi trong việc sản xuất các chất kích nổ để đưa vào cuộc chiến đang diễn ra.[1]
| Thủy ngân(II) nitrat | |
|---|---|
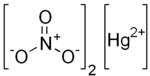 | |
| Danh pháp IUPAC | Mercury dinitrate Mercury(II) nitrate |
| Tên khác | Mercuric nitrate |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| Số RTECS | OW8225000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| UNII | |
| Thuộc tính | |
| Công thức phân tử | Hg(NO3)2 |
| Khối lượng mol | 324,5984 g/mol (khan) 342,61368 g/mol (1 nước) |
| Bề ngoài | tinh thể không màu hoặc bột trắng |
| Mùi | sharp |
| Khối lượng riêng | 4,3 g/cm³ (ngậm 1 nước) |
| Điểm nóng chảy | 79 °C (352 K; 174 °F) (1 nước) |
| Điểm sôi | |
| Độ hòa tan trong nước | tan |
| Độ hòa tan | hòa tan trong axit nitric, acetone, amonia không hòa tan trong alcohol |
| MagSus | −74.0·10−6 cm³/mol |
| Các nguy hiểm | |
| Phân loại của EU | Rất độc (T+) Nguy hiểm cho môi trường (N) |
| NFPA 704 |
|
| Chỉ dẫn R | R26/27/28, R33, R50/53 |
| Chỉ dẫn S | (S1/2), S13, S28, S45, S60, S61 |
| Điểm bắt lửa | Không bắt lửa |
| Các hợp chất liên quan | |
| Anion khác | Thủy ngân(II) sulfat Thủy ngân(II) chloride |
| Cation khác | Kẽm(II) nitrat Cadmi(II) nitrat |
| Hợp chất liên quan | Thủy ngân(I) nitrat |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Sản xuất
sửaThủy ngân(II) nitrat được tạo ra bằng phản ứng giữa axit nitric nóng đậm đặc với kim loại thủy ngân, trong các điều kiện này, axit nitric là một chất oxy hóa. Pha loãng axit nitric sẽ tạo ra thủy ngân(I) nitrat.
Ứng dụng
sửaThủy ngân(II) nitrat được sử dụng trong các phản ứng thủy ngân hóa. Đặc biệt, nó được sử dụng trong các phản ứng liên quan đến ketone. Một trong những chất hoá học mà có phản ứng mạnh nhất là acetone. Phản ứng này sử dụng thủy ngân nitric, oxit thủy ngân và calci sulfat để biến đổi aceton, CH3C(O)CH3 thành CH3C(O)CH2HgI. Acetone là một hợp chất mà hầu hết các phương pháp thủy ngân hóa khác được chứng minh là không hiệu quả.[2] Hợp chất nitrat thủy ngân hoạt động vì nó là một tác nhân oxy hóa mạnh.[3] Ngoài ra, khi thủy ngân được hòa tan trong axit nitric, dạng axit của nitrat thủy ngân được hình thành.[4] Dạng axit này có khả năng đảo ngược các phân tử sucrose.[5]
Tham khảo
sửa- ^ “The Not-So-Mad Hatter: Occupational Hazards of Mercury”. Bản gốc lưu trữ ngày 2 tháng 12 năm 2013. Truy cập ngày 20 tháng 9 năm 2017.
- ^ “Mercuration of Ketones and Some Other Compounds with Mercuric Nitrate”.
- ^ “Mercuric Nitrate”.
- ^ “Foods:Their Compostition and Analysis”.
- ^ “The Inversion of Sucrosse by Acid Mercuric Nitrate”.
Liên kết ngoài
sửa- ATSDR - Toxic Substances Portal - Mercury (11/14/2013)
- ATSDR - Public Health Statement: Mercury (11/14/2013)
- ATSDR - ALERT! Patterns of Metallic Mercury Exposure, 6/26/97 Lưu trữ 2000-01-15 tại Wayback Machine (link not traceable 11/14/2013)
- ATSDR - Medical Management Guidelines for Mercury Lưu trữ 2009-12-08 tại Wayback Machine (11/14/2013)
- ATSDR - Toxicological Profile: Mercury (11/14/2013)
- Safety data (MSDS)[liên kết hỏng] (link not traceable 11/14/2013)
- Mercuric Nitrate (ICSC)
- Mercury Lưu trữ 2018-02-17 tại Wayback Machine
- Mercury Information Packages Lưu trữ 2006-09-29 tại Wayback Machine
- How to Make Good Mercury Electrical Connections, Popular Science monthly, February 1919, Unnumbered page, Scanned by Google Books: https://books.google.com/books?id=7igDAAAAMBAJ&pg=PT14
